Обща характеристика на елементите от IV групата на главата групата
общински чуждестранна ипотека"Лицей No 43" на Саранск
Имам  читател по химия: Сисманова Н.Ю.
читател по химия: Сисманова Н.Ю.
Медии - урок по теми
« Загална характеристикаелемент IV А група. Вуглец ".
Мета урок
: Дайте характеристика на елементите от група IV A, покажете алотропията на вида във въглищата, атома на пъпката и Веселите власти, Дати разбират "адсорбция".
Предприятие и реактиви:
първоначалната електронна книга „Загална и неорганична химия“ (лаборатория за мултимедийни системи на МарСТУ), „Вуглец“, син лакмус, без активи на wugilla, нахално стъкло, паприлка паличка, фуния, фиал
Тип на урока
: Обяснение на новия материал.
Урок по хранене: (записано в точки) :
2. Въглерод. Алотропия във въглища.
3. Будова на атома и химическата мощност във въглищата.
4. Адсорбция.
5. Забит във въглища.
6. Обиколка във въглищата в природата.
Отидете на урок.
учител:Нова година свършва mo vivchati елементи 4 групи група на ръководителитепериодични системи. Помогнете ни с компютър. Бъдете виновни за уважителното изслушване, чудене и записване, за които ще обсъдим с вас цялото хранене за урока.
I. Преглед на диска (s кратка бележкасили и будов и атом във въглища).
1. Общи характеристики на елементите на групата IVA.
1) Elementi IVA група, класификацията им върху метални и неметални.
2) Познаване на природата.
3) Електронен бюджет на атомите, сходство и видимост.
4) Възможни етапи на окислени елементи.
5-6) Мъдростта на властите по групи е от въглища до олово.
7) Окислителни елементи, техните най -стилни.
8) Водневи елементи на естеството, тяхната будова и znhozhennya в природата.
Храна за фиксиране:
Какво е специално за елементите на групата в Budovia Atom и каква е разликата?
Как можем да променим силата на елементите от въглища в олово?
Yaku стъпки от окислена воня в оксиди и воднисти споли?
2. Вуглец. Алотропия във въглища.
1-2) Познанията за въглищата в природата и проявлението на алотропията.
3) Диамант, йога будова, власт, владение и притежание
4) Графит, йога будова, сила, мания и засосуване.
5) Карбин, йога будова, сила, мания.
6) Поликулен, йога будова, мощност.
7) Фулерен, йога будова.
Храна за фиксиране:
Познавали ли сте алотропни видове във въглищата?
Как можете да преминете от един вид в друг?
Чи е село и камъяне вугила алотропно със змии във въглища?
Да, как мислите, защо стиловете на богати алотропни модификации са във въглищата? (Способността да се чете на деня на храната, разпознаваем от атома на пъпката във въглерода).
3. Будова на атома и химическата мощност във въглищата.
8) Електронна и графична формула на атома във въглерод.
9) Майски етапи на окисляване във въглерод
10-13) Химия на мощността във въглищата (взаимодействие с метали, неметали, оксиди).
14) Взаимодействие със силни окислители (писане на пример за специфични за окислението реакции и настройване на ефективността по метода на електронния баланс).
15) Ангажиране с въглища с вода. Застой на дадената реакция.
Храна за фиксиране:
Какъв невинен атом ще отиде във въглищата?
Колко мощно е да се показва във въглища при взаимодействие с метали и неметали?
Yaka окислени стъпки в карбидите?
Какво може да се използва метал и неметал във въглерода от техните оксиди?
Каква е ролята в индустриалното състояние на реакцията във въглища с вода?
Какви активи не е необходимо да се забиват в медицински и протогаз?
II. Лабораторен робот.
4. Адсорбционно-це процес на преследване на повърхността плътно тялоридини(Чрез порести будови тила). Демонстрирайте явлението tse с предупреждение.
DOSVID: До края на синия лакмус за усъвършенстване на активите на vugilla. Vidfіltruvati otrimanu sumіsh. Filtrat е абсолютно проницателен.
III... Робот зад масите на манипулатора.(O.S. Gabrielian. Khimiya 9 -ти клас стр.131, стр.133)
5. Забит във въглища.(Погледнете таблицата на манипулатора и от района на района на потребление на въглища: vugilla, графит, сажди).
6. Обиколка във въглищата в природата.(Погледнете таблицата на манипулатора и z'yasuvati, тъй като процесите протичат в природата за частта от въглищата: gnittya, скитане, dichannya, gnittya, фотосинтеза).
IV. Zakriplennya vivcheny.
Разставяне изпълнение по метода на електронен баланс до нивото на дясно No 8 стр.134.
Основните характеристики на четвъртата група на пидгрупата на главата:
- а) силата на елементите от гледна точка на будов и атом;
- б) етап на окисляване;
- в) силата на оксидите;
- г) силата на хидроксидите;
- д) водни пътища.
а) Вуглец (C), силиций (Si), германий (Ge), калай (Sn), олово (Pb) - елементи от 4 групи на главата подгрупа PSE. На най-популярната електронна топка от атоми има 4 електрона: ns 2 np 2. При нарастване на серийния номер на елемента радиусът на атома нараства, неметалната мощност отслабва и металът се запълва: въглерод, германски
б) Елементите от цикъла на групата показват както положителни, така и отрицателни нива на окисление: -4, +2, +4.
в) Виши оксиди във въглерод и силиций (C0 2, Si0 2) могат да бъдат кисели, оксиди на други елементи от групата - амфотерни (Ge0 2, Sn0 2, Pb0 2).
г) Вугилна и силициева киселина (H 2 CO 3, H 2 SiO 3) - слаба киселина. Хидроксидният германий, калай и оловен амфотерий са със слаба киселинна и основна мощност: H 2 GeO 3 = Ge (OH) 4, H 2 SnO 3 = Sn (OH) 4, H 2 PbO 3 = Pb (OH) 4.
д) Водневи сполуки:
СН4; SiH 4, GeH 4. SnH 4, PbH 4. Метан - CH 4 - митнево съединение, силан SiH 4 - меншо митне zеdnannya.
Схеми за развитие на атоми във въглерод и силиций, например, например в мощност.
З lS 2 2S 2 2p 2;
Si 1S 2 2S 2 2P 6 3S 2 3p 2.
Въглеродът и силицийът са неметали, тъй като на най -новата електронна топка има 4 електрона. Ако силицийът е по -малък от радиуса на атома, той е по -характерен за новата електроника, но не и за въглерода. Вуглец - олово:
Завданя. Как да донесем, как графитът и диамантът са алотропни под формата на един и същ химичен елемент? Кой може да обясни мнението на властите?
Решение. І диамант, и графит, когато се запали в кисело, окисът се превръща във въглерод (IV) C0 2, когато преминава през вода, vipadê утайка калциев карбонат CaCO 3
Z + 0 2 = CO 2; C0 2 + Ca (OH) 2 = CaCO 3 v - H 2 O.
В допълнение, диамантът може да бъде отрязан от графита, когато се нагрява във висок тиск. От същото време, до склада и графитът, и диамантът са включени само във въглищата. Разликата в мощността на графита и диаманта се обяснява с разликата в кристалната решетка.
В кристалните разтвори диамантът има обвивка във въглерода на изхвърлянето от компанията. Атомите са изпечени към един и същ произход, един от един и дори по -леко привързани заедно с ковалентни връзки. Цим ще обясни голямата твърдост на диаманта.
Графитът има атоми във въглерода с успоредни топки. Излизайте между окачени топки в по -голям мащаб, отдолу между суспендирани атоми в топка. Ще добавя малкотата на звука към звука между топките, а графитът лесно се разделя на тънки парчета, които са още по -микроскопични.
Зъединение с воднем, което ощипвам с въглен. Емпирични формули, тип хибридизация на атомите във въглерод, валентност и етапи на окисляване на кожния елемент.


Етапът на окисляване в повечето случаи е +1.
Валентността на пътя е една, валентността на въглищата е тази, която е.
Формули на силни и силициеви киселини, с химическа мощ по отношение на редукция до метали, оксиди, подстав, специфична мощност.
H 2 CO 3 - вугилова киселина,
H 2 SiO 3 - силициева киселина.
H 2 CO 3 - исно тилки в диапазона:
H 2 C0 3 = H 2 O + C0 2
Н 2 SiO 3 е твърда река, практически нерастяща се във вода, поради което водните катиони във водата практически не се отделят. При връзката с цим има и голяма мощност на киселините, като за индикатора Н 2 SiO 3 не може да бъде повлиян, той е дори по -слаб от силна киселина.
Н 2 SiO 3 - нетривиална киселина; при нагряване постепенно се разширява:
H 2 SiO 3 = Si0 2 + H 2 0.
Н 2 CO 3 реагира с метали, метални оксиди, подразделения:
а) H 2 CO 3 + Mg = MgCO 3 + H 2
б) H 2 CO 3 + CaO = CaCO 3 + H 2 0
в) H 2 CO 3 + 2NaOH = Na 2 CO 3 + 2H 2 0
Химическа мощ на въглеродната киселина:
- 1) алкохолни киселини,
- 2) специфична мощност.
Доказателства за потвърждаване на подобни реакции.
1) реакция с активни метали:

Завданя. В допълнение, химическото възстановяване на количеството силициев оксид (IV), калциев карбонат и среда, последният компонент на сумата. Опишете края на деня.
Решение.
1) до пълния прилив на солна киселина.
план на урока
Началните характеристики на елементите от IV А група.
Въглерод и силиций
мета:
покритие:формулират в стипендии в задния дворза елементите, които да влязат в склада на 4 - групата, жизнеността на основната мощност, погледнете биохимичната роля и съхранението на основните елементи на деня.
развитие:за разработване на съветите за писане и писане, съобщения, съобщения, vikoristovuvati otrimanі знания за новите предприятия.
vihovuє:виховати почти да консумира новите знания.
Отидете на урок
Повторение на преминалите:
Колко елемента се използват преди неметали? Искате ли да е в PSKHE?
Какви са елементите на органогенното съдържание?
Въведете модулна мелница за всички неметали.
Какви са молекулите на неметали?
Оксидите се наричат несолеобразуващи? Напишете формулите за несолеобразуващи оксиди на неметали.
Cl 2 → HCl → CuCl 2 → ZnCl 2 → AgCl
Останалата реакция на ривняня се записва в йонната виглиада.
Добавете следните възможни реакции:
1) H 2 + Cl 2 = 6) CuO + H 2 =
2) Fe + Cl 2 = 7) KBr + I 2 =
3) NaCl + Br 2 = 8) Al + I 2 =
4) Br 2 + KI = 9) F 2 + H 2 O =
5) Ca + H 2 = 10) SiO 2 + HF =
Запишете реакциите на rivnyannnya при взаимодействието на азота с а) калций; б) с вода; в) кисел.
Zd_ysniti lantsyuzhok трансформация:
N 2 → Li 3 N → NH 3 → NO → NO 2 → HNO 3
Когато се разпределят 192 g амониев нитрит съгласно реакцията NH4NO2 = N2 + 2H2O, се добавят 60 литра азот. Теоретично е възможно да се знае начинът на продукт.
Vivchennya нов материал.
До 4 A група има p-елементи: въглерод, силиций, германий, калай и олово. Въз основа на броя на енергийните раси, неенергизираните атоми могат да бъдат на новото ниво за 4 електрона. Във връзка с увеличаването на групата отгоре надолу, броя на съхранените електронни топки и размера на атома. Протеинът във въглерод и силиций често се получава от силата на всички елементи. Всички видове неметали. Германийът има метални знаци, а калай и олово имат воня от неметални.
В природата във въгленСтанете диамант и графит във виленски лагер. Zm_st във въглищата в земната кора става близо до 0,1%. Вин да влезе в склада на естествени карбонати: вапняк, мармур, крейди, магнезит, доломит. Вуглец е глава складова часторганична реч. Вугила, торф, нафта, дърва и природен газ могат да се разглеждат като гориво, така че да се застояват в огъня.
Физическа сила.Вуглец Як е проста дума в кръг от алотропни форми: диамант, графит, карабин и фулерен, които могат да бъдат бързо разработени Физическа сила, Ще се обясня на пъпките на кристалните решетки. Карабина -фино кристален прах с черен цвят, за първи път синтезиран през 60-те години от радианските химици, поради познанията в природата. При нагряване до 2800º без достъп се превръща в графит. Фулерен -през 80 -те години булите синтезират сферични структури, определени от атоми във въглерод, наречени фулерени.Вонята е затворена структура, която се състои от единствен брой атоми във въглищата - Z 60, Z 70.
Веселите власти.Химически изпечени във въглища при здрави умовеинертен. Скоростта на реакция ще се адаптира към коригираната температура. При високи температури въглищата се смесват с вода, кисели, азотни, халогени, вода и някои метали и киселини.
Ако залогът за вода е преминал през вугилите, коксът трябва да се освободи от количеството оксид в грубия (II) и водния:
° С + З 2 О = CO + З 2 (пара),
Реакцията протича при 1200º, при температури по -ниски от 1000º, окисляване се извършва до CO 2 :
З + 2З 2 О= CO 2 + 2 З 2 .
Промислово важен процес е превръщането на водния газ в метанол (метилов алкохол):
CO + 2З 2 = CH 3 ВІН
При високи температури, инжектирани във въглищната сграда с метали, карбиден,в средата на тях те виждат „метан“ и „ацетилен“, в присъствието на отлагания, който газ се вижда, когато взаимодействат с вода или киселина:
Сас 2 + НС1 = CaCl 2 + ° С 2 З 2
Ал 4 ° С 3 + 12 З 2 О = 2 Ал(ОХ) 3 ↓ + 3 CH 4
Голяма практическа стойност е калциевият карбид, който може да се използва за загряване на CaO и коксовото изпаряване в електрически фурни без достъп до храна:
CaO + 3C = Sac 2 + CO
Вискорист на калциев карбид за отхвърляне на ацетилен:
Сас 2 + 2 З 2 О= Ca (OH) 2 + ° С 2 З 2
За въглищата обаче характерните реакции, при които вината показват новата сила:
2 ZnO + ° С = Zn+ CO 2
° СКонсолидация във въглища.
Въглеродният оксид (CO) е мръсен газ. На промишлено ниво е необходимо да се разпределят проходите във въглероден диоксид при изпичането на вугилите при висока температура... В лабораторни мивки, CO може да разпредели концентрация на сярна киселина и киселина от цариградско грозде при нагряване (сярната киселина е вода):
NSOOH =З 2 О+ CO
Оксидът във въглерод (CO 2) е въглероден диоксид. В атмосфера на въглероден диоксид, малко 0,03% тегловни, или 0,04% тегловни. Доставете в атмосферата на вулкана и горещата джерела и хората, изгаряйки горими копалини, изгарят. Атмосферата през целия час обменя газове с океанска вода, като например отмъщение 60 пъти повече във въглероден диоксид, по -малко атмосфера. Изглежда, въглеродният диоксид е добър за сънливи алеи в инфрачервената област на спектъра. Тим ще изключи въглеродния диоксид сам парников ефекти регулира глобалната температура.
При лабораторни мивки въглеродният диоксид се измива със солна киселина за мармур:
CaCO 3 + 2 НС1 = CaCl 2 + З 2 О+ CO 2
Силата на въглеродния диоксид не води до пожари в други приложения. Когато се регулира сцеплението, разликата в въглеродния диоксид нараства бързо. Като цяло грундът трябва да се взема от газирани напитки.
Вугиловата киселина е нежелана в разтвор. При нагряване разликата се отлага върху оксид във въглерод и вода. Солите на киселината са твърди, ако самата киселина е нестабилна.
Найважлива реакция към карбонат - йон е разреждане на минерални киселини - солна или сирчаной. При много тръни луковиците се виждат във въглероден диоксид и когато се прекара през разтвора, калциевият хидроксид (вода) се помътнява в резултат на потвърждаването на калциевия карбонат.
Силиций.Писане на най -популярния елемент на Земята. Vin стават 25,7% от масата на земните морбили. Значителната част е представена от силициев оксид, т.нар силициев диоксид, Яки да се види при вида на писта или кварц. При много чист виглиад, силициевият оксид расте в минерала вигляд, т.нар гирски криштал.Кристален силициев оксид, съставен от малки къщички, изработени от скъпи камъни: ахат, аметист, яспис. Групата на природните ресурси на Инша, която прави силициевите силикати - загубена силициева киселина.
За промишлен силициев диоксид, той се обработва с кокс в електрически пещи за нов силициев оксид:
SiO 2 + 2 ° С = Si + 2 CO
В лабораториите, в качеството на предшествениците, има магнезий или алуминий:
SiO 2 + 2Mg = Si + 2MgO
3 SiO 2 + 4Al = Si + 2Al 2 О 3 .
Най -чистият силиций се получава чрез редукция на силициев тетрахлорид с цинкови пари:
SiCl 4 + 2 Zn = Si + 2 ZnCl 2
Физическа сила.Кристалният силиций е кристал с тъмно сив цвят със стоманена петна. Структурата на силиция е подобна на тази на диаманта. Silicon vicorist в качеството на водач. Ние сме така наречени батерии за сън, Zdatnі преобразува отново енергията на svitlovu в електричество. Силицият е порочен в металургията за отстраняване на силициеви стомани, които имат висока устойчивост на топлина и киселина.
Веселите власти.Зад химическите сили на силиция, подобно на въглищата, е неметален или дори неметален, той се люлее по-слабо, така че стойността на атомния радиус е по-голяма.
Силиконът с екстравагантни умове е шик, за да завърши с енергия. Bezposeredno vín vzaêmodíê tílki с флуор, сливащ флуорид със силиций:
Si + 2 F 2 = SiF 4
Киселините (с изключение на сумата от флуороводородна HF и азотна) не преминават върху силиций. Ale vin може да се използва в хидроксидни метали:
Si + NaOH + H 2 O = Na 2 SiO 3 + 2Н 2
При високи температури в електрическата пещ количеството торта и коксът трябва да се консумират със силициев карбид. SiC- карборунд:
SiO 2 + 2С =SiC+ CO 2
Шлифовъчните камъни и шлифовъчните кръгове са изработени от силициев карбид.
Споли на метали със силиций се наричат силицид:
Si + 2 Mg = Mg 2 Si
Когато използвате силицид с магнезиева хлороводородна киселина, използвайте най -простата водка със силиций силан -SiH 4 :
Mg 2 Si+ 4nsл = 2 MdCl 2 + SiH 4
Silan е обиден газ с неприемлива миризма, който се запалва сутрин.
Zjeddnannya кремък. Силициев диоксид- твърда огнеупорна река. В природата разширения в две форми кристален и аморфен силициев диоксид. Силициева киселина- е слаба киселина, при нагряване лесно се отлага върху вода и силициев диоксид. Можете също така да бъдете отримана яко при виглядите на желеобразна маса, за да отмъстите на водата, както и при виглядите на колоиден рош (сол). Соли на силициева киселинапозвънявам си силикатами.Естествена мощност - за да достигнете сгъваемите сполуки, в склада им извикайте изображението на яко от декилковите оксиди. Tilki silikati сода и калории във водата. Името им с люлеещ се наклон,и техните различия - рядък склон.
Завданя за zakr_plennya.
2. За да добавите мотива за еднакви реакции, за да завършите задачата.
| 1 отбор
| 2 отбора
| 3 отбора
|
| H 2 SO 4 + HCl - | CaCO 3 +? -? + CO 2 + H 2 O |
|
| NaOH + H 2 SO 4 - | CaCO 3 + H 2 SO 4 - | K 2 SO 4 + CO 2 + H 2 O - |
| CaCl 2 + Na 2 Si O 3 - |
||
| Si O 2 + H 2 SO 4 - | ||
| Ca 2+ + CO 3 -2 - | CaCl 2 ++ NaOH - |
|
| завданя: Когато оксидът (111) беше въведен във въглища, бяха отстранени 10,08 g злато, което загуби 90% от теоретично възможния добив. Як маса, взета за оксид zaliz (III)? | завданя: Колко е необходимо за силикат натрий, когато е легиран със силициев (IV) оксид от 64,2 кг натрий, защо трябва да се премахнат 5% от къщата? | завданя: С хлороводородна киселина на 50 g калциев карбонат бяха взети 20 g оксид във въглерод (IV). Какъв вид оксид във въглерод (IV) (в%) като теоретично мъхест? |
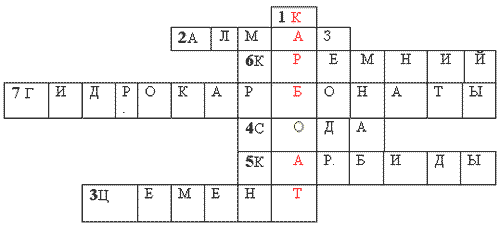
Кръстословица.
NSза вертикала: 1. Тишина на въглена киселина.
Хоризонтално: 1. Най -солидната естествена реч на Земята. 2. Образователни материали. 3. Речовина, Як ще бъде скрита за подготовката на теста. 4. Ziednannya силиций с метали. 5. Елемент на главата pidgroup 1V група PS химични елементи... 6. Соли на въглена киселина, която помага за отмъщението за водата. 7. Естествено съединение силиций.
Домашна работа:страна 210 - 229.
Тема:Първоначалните характеристики на елементите от група IV-A.
Мощност.
мета : Разгледайте характеристиките на елементите IV-A група върху дупето във въглища и силиций; физическа и химична сила на тези елементи, давайки разбиране за "абсорбция".
осветление : прочетете учените независимо zdobuvati знания рационално vikorystannyaизни джерел информации (ръководители, научно-популярна литература) и използващи итримани знания; Установете причинно -следствена връзка между жителите на Будва, властите и историята на речта въз основа на образователни теории, публичност и систематизиране на знанията на учените за въглерода и силиция в историята на хората;
Развиващи се : развитие на образователния интерес на учениците, в съзнанието да видят главата, да я извадят, да я използват, логическо мислене;
vikhovuvati здравословно поведение в класната стая.
установка: Компютър, презентация, манипулатор, таблица "Периодична система от химични елементи"
Отидете на урока:
1. Организационен момент.
2. Проверете домашната работа.
3. Актуализиране на основните знания
(Челна бесида).
Назовете елементите, които да въведете предиIVгрупа.
Назовете елементите по pidgroupIVгрупово.
4. Изучаване на нов материал.
Положението в периодичните системи на химични елементи, будовите на атома С,Si
учител ... Хлопс, нека се чудим периодична системахимични елементи и е важно елементите да включватАзV-A pidgroup?
Видповид учен.
Начело на групатаАзV-A гр. Въвеждане на елементи:° С, Si, Ge, Sn, Pb-
C, Si, Ge - неметали - Sn, Pb - метали
учител ... Какво спилно в Будови атомив цих елементи?
( учене на робот от бебето )
1. Вуглец
6 В) 2) 4
…2 с22 стр2
2. Силиций
14 Si) 2) 8) 4
…3 с23 стр2
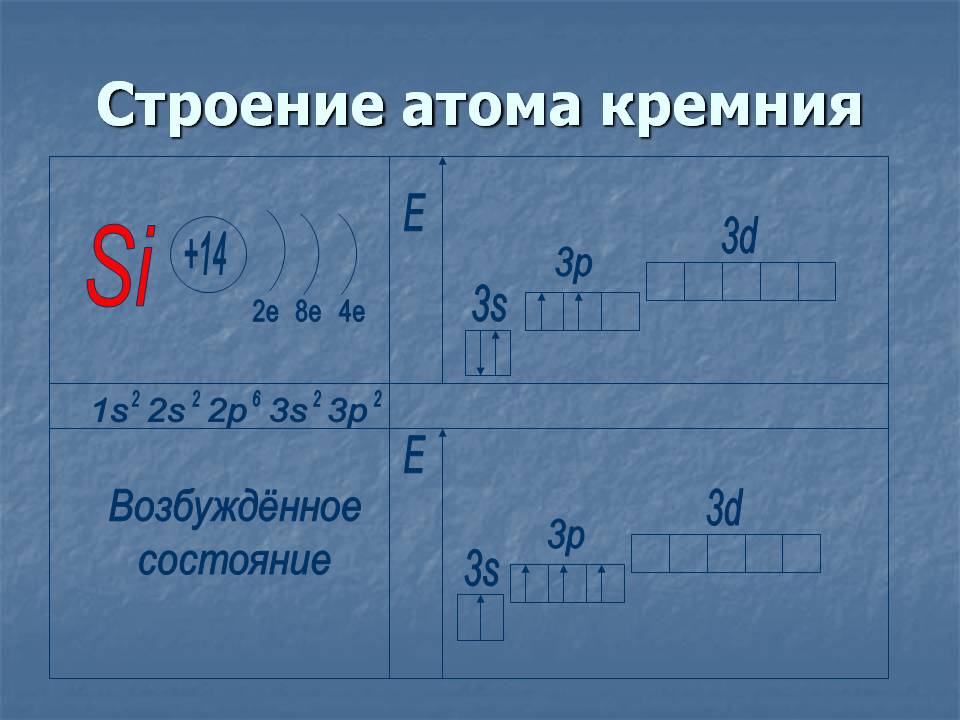
оценен от учения ... Може същия будов атом (при последното ривни 4е).ns 2 np 2 и валентностII, IV
Учител. Как се отклоняваш от силата на елементите от големите?
оценен от учения ... Растежът на мощността на метала нараства с нарастването на метала, но се променя на мощността на неметала.
учител ... Yaki vischі оксиди и одобряват елементите на 1V-A група?
оценен от учения ... Конфигурирайте виски оксиди тип -RO 2 ( робот учня биля дошки ) CO 2, SiO 2 Ge О 2 SnO 2 PbО 2
Учител. Як летящи водни сполуки настройка на елементите?
Видповид учен. Тип летяща водаRH 4 ( CH 4 , SiH 4 )
Учител. Във въглищата ще поставя 2 алотропни вида: графит, диамант
Таблица "Будова кристални решетки за диамант и графит"
алотропия във въглерод
графит
диамант
Физическа сила
тъмно сиво, провеждат електрически поток и загряват
Prozore е кристална твърда реч с характерно мигане.
t = 1420 топене; не провеждайте електрически поток и топлина
Робот в групи с белезници. Обмен на информация. Запис в зошита.
Група №1 Група №2
Z
Si
знания в природата
Клас CaCO 3 мармуров диамант
графит
малахит CuCO 3
нафта
27% земни морбили - SiO сок 2
Веселите власти
С + 2Н 2 → CH 4
C + O 2 → CO 2
3 C +4 AL → AL 4 ° С 3
Ca + 2C → CaC 2
2 AL 2 О 3 + 3C → 4AL + 3CO 2
Si + O 2 → Si O 2
Si + 2CL 2 → SiCL 4
Si + 2Br 2 → SiBr 4
2Mg + Si → Mg 2 Si
смучене
накрайници за пробиване, склоризи, мелница на прах, скъпи камъни,медицинско почистване на алкохол от сивушни масла
изчистване на цукру в рафинерии от речовини, които произвеждат youma жовти колир
въз основа на адсорбционната сила на дървесината vugilla руски химик Николай Дмитрович Зелински разбива филтърния газ
(Демонстрация на филтърни кутии Budovi пред Protigaz).
Доставчик (спящи батерии)
стомана
събуждане по телефона
Адсорбция-– добро качество на газта и разпознаване на речвърху повърхността на твърди ридини(Чрез порести будови тила).
Проблем с храненето: Адсорбцията физически ли е или химичен процес?
Демонстрационен dosvid "Адсорбция".DOSVID: До края на синия лакмус за усъвършенстване на активите на vugilla. Vidfіltruvati otrimanu sumіsh. Filtrat е абсолютно проницателен.
VIDPOVID : физически, за който складът на речта не се променя
5Систематични и обществени познания
Здисните ревизия. Напишете обобщение на реакцията.
CH 4 ← ° С → CO → CO 2 → З 2 CO 3
CaCC 2
рефлексия
Yak vi vvazhaête, защо нашият урок е представен?
Бихте ли искали да видите виконт повече пъти, но бихте ли го играли по различен начин?
Виждали ли сте положителни емоции от тазгодишния урок?
6. Д / с
Преди склада на групата има 5 елемента: два неметала-въглерод и силиций, които се намират в другия и третия период на Менделовата система и 3 метала-Нимеччин (междинен между неметали и метали, калай и олово в IV, VI. За всички тези елементи е характерно, че сто смърди на новото енергийно ниво от 4 електрона. Освен това е възможно да се покажат стъпките на окисляване от +4 до -4. 4, PbН 4. когато се отоплявате в делничен ден, се отървете от елементите на храната, водата и халогените.
Етапът на окисляване +4 трябва да премине, когато 1s-електроните отидат във вертикалната р-орбитала. С увеличаването на радиуса на атома връзката между звънещите електрони и ядрото ще се промени. Неметалната мощност ще се промени, но металът ще расте. (Температурата на топене и точка на кипене и т.н. намалява)
калайза да не се открие броят на широко разпространените метали (вместо 0,04% в земната кора), е доста лесно да се стопи от руди и това се е превърнало в СЛЪНЧЕВ народ в полезрението на сплави от обяд (бронз) от древността пъти. Да се види при вида на киселата сполука SnO 2 (калаен камък, от който да отидем за допълнителна актуализация). В една вилна мелница калайът е копринено-бежов метал. С ламаринена пръчка калай можете да усетите характерното потрепване на решетките на кристалите един по един.
Калайът е мек и вискозен и може лесно да се разточва на тънки листове, наречени калайдисано фолио или станил.
Крим на зичанията бяла калай, Кристализира се в тетрагон, ако е по -малко от вид калай - сър калайКристализирайте в кубична система и ви дава по -малко енергия. Калайът е по -стабилен при температури по -високи от 14 ° C, а ферментът при температури под 14 ° C, така че когато се охлади, калайът се трансформира в майка. В zv'yazyu zі zynuyu znіnoy zmenіnuyu sіlnosti метал, когато tsyomu rassypayetsya в сив прах. Ще нарека това явление калаена чума. По -добре е цялата трансформация на бял калай да се нагрява при температури близки до 30 ° C; по -бързо в присъствието на микроби на кристали от сив калай.
Сплав калай с сурмоа и го застой за подготовката на лагери. Tsi синтез (калай бабити) volodyut високи антифрикционни сили. Сплави от калай с олово - pripіy - се използват широко за запояване. Компонентът от легиращ як калай е включен в сплавите midi. При стайна температура калайът не се окислява при стайна температура, но се загрява стъпка по стъпка до температурата на топене, за да се трансформира в калаен диоксид SnO 2 вода не се използва за калай. Добавя се солната киселина и киселината се добавя още повече. Концентрираната киселина при нагряване разбива калай.
Sn + 2 НСl = SnСl 2 + Н 2 #
Sn + 4H 2 SO 4 = Sn (SO 4) 2 + 2 SO 2 # + 4H 2 O
По -концентрирана азотна киселина, по -интензивна реакция
4Sn + 10 HNO 3 = 4Sn (NO 3) 2 + NH 4 NO 3 + 3H 2 O
Sn + 4 НNО 3 = Н 2 SnО 3 $ + 4NО 2 # + Н 2 О в концентрация
Концентрираните ливади реагират Sn + 2NаОН = N а 2 SnО 2 + Н 2 #
Na 2 SnO 2 Станете натрий. При разчина соли хидратирани (оточени с водни молекули). От друга страна, покрийте тавата с втвърден плавкой. Комплект от слоева сполука Nа 2
40% калай се намира в производството на консерви. Зализо е покрит с калай. Калай се използва за поставяне на стийки сполукс със стъпки на окисление +2, +4.
SnO (II) -гов прах, отидете при отваряне Sn (OH) 2 -амфотерен хидроксид Sn (OH) 2 + 2NаОН = N а
Калаеният диоксид се среща в природата. Потвърдете, когато спите Sn сутрин.
Калаената киселина Н 2 SnО 3 е неразтворима (билиев прах) във връзка с ливади Н 2 SnО 3 + 2 NaOH + Н 2 О = N а 2
Калаеният хлорид е розово SnCl 2, калаеният хидрид SnH 4 е безцветен, дори отпадъчен газ.
Водя.Руда. Каквото и олово да бъде отстранено, се нарича оловен флакон.
PbS + 3О 2 = 2PbО + 2SО 2 - печене.
Да се разтопи PbO заедно с кокса и да се отстрани оловото и след това да се почисти.
Оловото е важен метал. Виното е меко и се смейте с нож.
Оловото се използва широко в технологиите. Повечето витамини са необходими за приготвяне на кабелни обвивки и плочи за батерии. Оловото се използва за приготвяне на боеприпаси и изстрел. Vin, за да влезе в склада на багатох сплави (лагери, drukarsky шрифт, спойка). Оловото е добро g - viprominuvannya и vikoristovuyutsya за улавяне на тях с роботи с радиоактивни речи.
Понякога лесно се окислява и се покрива с окислен оксид, който може да се събере в резултат на окисляване. Водата не е взаимозаменяема с олово, а по -скоро в присъствието на разрушителна напитка. 2Pb + О 2 + 2Н 2 О = 2Pb (ОН) 2
Когато се забие в бурна вода, покрийте го с тънък поплавък от неподходящи соли и не се разпадайте.
Разреден със солна киселина и сирчанова киселина и може да не реагира с олово. С концентрирана кисела киселина, при нагряване, въведете Pb (HSO 4) 2.
С разреден реактив на азотна киселина, намалете с концентриран. взаимодействие с ливади Pb + 4КОН + Н 2 О = К 4 + Н 2 # хидроксоплумбит калия.
Характерни са етапите на окисляване +2, +4
PbО = - жълт прах при пържене (500 о С), набъбнал с червеникаво -жълт цвят и се нарича литардж.
Оловен хидроксид Pb (OH) 2 амфотерен.
Pb (OH) 2 + 4 NaOH = 2 Na
Когато Pb (OH) 2 е сплав, соли на отвес се появяват в сухи ливади:
Pb (OH) 2 + 2 NaOH = N а 2 PbО 2 + 2Н 2 О
Оловен ацетат се стабилизира при фарбуване на Pb (СН 3 СОО) 2
PbS - черен цвят. Papier, zmocheniya razchin сол олово shvidko тъмно, както всеки ден е sirwater. Проста реакция на солена вода. Spoluki lead (IV) -Sil plumbati CaO + PbO = Ca PbO 3
Акумулаторите се съхраняват в тънки оловни плочи, едната пълна с оловен диоксид, а инши - с метален гъбен олово. Плочите се пробиват с размер 35-40% Н 2 SO 4. при изпускане на робота: Pb + SO 4 2- ® PbSO 4 $ + 2е
Металното олово се окислява и оловният диоксид се подновява.
PbО 2 + SO 4 2 - + 4Н + ® Pb SO 4 $ + Н 2 О
Електроните, които се водят от оловни атоми, се предават през последната фура. Pb е анодът, а PbO 2 е катодът. В случая на H 2 SO 4 се наблюдава прехвърляне на йони. Ioni SO 4 2- - срутване към анода, H + - към катода.








