Galvas grupas IV grupas elementu vispārīgās īpašības
pašvaldības ārvalstu hipotēka Saranskas "Licejs Nr. 43"
Ir  ķīmijas lasītājs: Sismanova N.Yu.
ķīmijas lasītājs: Sismanova N.Yu.
Mediji - nodarbība par tēmām
« Zagalna iezīme IV elements A grupa. Vuglets ".
Meta nodarbība
: Raksturojiet IV A grupas elementus, parādiet oglēs esošo sugu alotropiju, pumpuru atomu un Jautras autoritātes, Dati saprot "adsorbciju".
Iekārta un reaģenti:
Sākotnējā elektroniskā grāmata "Zagalna un neorganiskā ķīmija" (MarSTU multimediju sistēmu laboratorija), "Vuglets", zils lakmusa, bez wugilla aktīviem, nekaunīgs stikls, papilārā palička, piltuve, stikls
Nodarbības veids
: Jaunā materiāla skaidrojums.
Maltītes mācība :( ierakstīts dozās) :
2. Ogleklis. Allotropija akmeņoglēs.
3. Budova par atomu un ķīmisko spēku akmeņoglēs.
4. Adsorbcija.
5. iestrēdzis oglēs.
6. Apkārtmērs oglēs dabā.
Iet uz nodarbību.
skolotājs: Daudz laimes dzimšanas dienā mo vivchati elementi 4 grupas galvas grupa periodiskās sistēmas. Palīdziet mums ar datoru. Esi vainīgs, ka ar cieņu to dzirdi, brīnies un pieraksti, par kuru mēs ar tevi pārrunāsim visu stundas uzturu.
I. Diska (-u) apskats īsa piezīme pilnvaras і budov un atoms oglēs).
1. IVA grupas elementu vispārīgās īpašības.
1) Elementi IVA grupa, classificationх klasifikācija uz metāla un nemetāla.
2) Zināšanas par dabu.
3) Atomu elektroniskais budžets, līdzība un redzamība.
4) Iespējamie oksidēto elementu posmi.
5-6) Iestāžu gudrība pa grupām ir no oglēm līdz svinam.
7) Oksidācijas elementi, stikх stikіst.
8) Vodnevі z'єdnannya elementi, їkh budova un znhozhennya dabā.
Pārtika fiksēšanai:
Kas ir īpašs grupas elementiem Budovia Atom un kāda ir atšķirība?
Kā mēs varam mainīt elementu jaudu no oglēm uz svinu?
Yaku soļi no oksidētās smakas oksīdos un ūdeņainos spolumos?
2. Vuglets. Allotropija akmeņoglēs.
1-2) Zināšanas par oglēm dabā un alotropijas izpausme.
3) Dimants, yogo budova, vara, valdīšana un valdīšana
4) Grafit, yogo budova, vara, apsēstība un zasosuvannya.
5) Karbins, jogo budova, spēks, apsēstība.
6) Polikomulen, yogo budova, jauda.
7) Fullerēns, jogo budova.
Pārtika fiksēšanai:
Vai jūs zinājāt ogļu alotropās sugas?
Kā jūs varat pāriet no vienas sugas uz otru?
Chi є ciems un kam'yane vugіlla alotropic ar čūskām oglēs?
Yak jūs domājat, kāpēc ogļu bagātīgo allotropo modifikāciju stili? (Ideja par iespēju izlasīt uzturu, kas ir zināms no oglekļa pumpura atoma).
3. Budova par atomu un ķīmisko spēku akmeņoglēs.
8) Elektroniskā un grafiskā atoma formula ogleklī.
9) Maija oksidācijas posmi ogleklī
10-13) Ogļu jaudas ķīmija (mijiedarbība ar metāliem, nemetāliem, oksīdiem).
14) Mijiedarbība ar spēcīgiem oksidētājiem (rakstot piemēru par oksidācijai raksturīgām reakcijām un iestatot veiktspēju ar elektroniskā līdzsvara metodi).
15) Iesaistīšanās oglēs ar ūdeni. Dotās reakcijas stagnācija.
Pārtika fiksēšanai:
Kāds nevainīgs atoms Budovī pāries uz oglekli?
Cik spēcīgi ir parādīties oglēs, mijiedarbojoties ar metāliem un nemetāliem?
Yaka oksidēti soļi karbīdos?
Ko metālu un nemetālu var izmantot ogleklī no to oksīdiem?
Kāda loma ir rūpnieciskajā stāvoklī ogļu reakcijā ar ūdeni?
Kādiem aktīviem nav jābūt iestrēgtiem medicīnā un protogāzē?
II. Laboratorijas robots.
4. Virsmas vajāšanas adsorbcijas process ciets ķermenis ridini(Caur porainu budovi tila). Demonstrējiet tse parādību ar brīdinājumu.
DOSVID: Līdz zilā lakmusa beigām, lai pilnveidotu vugilla aktīvus. Vidfіltruvati otrimanu sumіsh. Filtrats ir absolūti iespaidīgs.
III... Robots aiz hendlera galdiem.(O.S. Gabrielian. Khimiya 9. klase 131. lpp., 133. lpp.)
5. iestrēdzis oglēs.(Paskatieties uz hendlera tabulu un no reģiona, kurā tiek patērēts ogles: vugilla, grafīts, kvēpi).
6. Apkārtmērs oglēs dabā.(Paskatieties uz hendlera un z'yasuvati tabulu, jo procesi ogļu daļai iet dabā: gnitty, klaiņojošs, dikhannya, gnittya, fotosintēze).
IV. Zakrіpennya vivcheny.
Razstavte sniegums ar elektroniskā līdzsvara metodi līdz labajam līmenim Nr.8 lpp.134.
Galvas pidgrupas ceturtās grupas galvenās iezīmes:
- a) elementu jauda no budova un atoma viedokļa;
- b) oksidācijas stadija;
- c) oksīdu spēks;
- d) hidroksīdu jauda;
- e) ūdensceļi.
a) Vuglets (C), silīcijs (Si), germānijs (Ge), alva (Sn), svins (Pb) - PSE galvas grupas 4 grupu elementi. Uz populārākās elektroniskās atomu lodītes ir 4 elektroni: ns 2 np 2. Pieaugot elementa sērijas numuram, tiek palielināts atomu rādiuss, nemetāliskā jauda un metāls tiek patērēts: ogleklis ir vācietis
b) Grupas cikla elementi parāda gan pozitīvo, gan negatīvo oksidācijas līmeni: -4, +2, +4.
c) Vishі oksīdi ogleklī un silīcijā (C0 2, Si0 2) var būt skābi, citu grupas elementu oksīdi - amfoterni (Ge0 2, Sn0 2, Pb0 2).
d) Vugilna un silīcijskābe (H 2 CO 3, H 2 SiO 3) - vāja skābe. Germānija hidroksīds, alva un svina amfotērijs ir vāji skābi un bāzes spējas: H 2 GeO 3 = Ge (OH) 4, H 2 SnO 3 = Sn (OH) 4, H 2 PbO 3 = Pb (OH) 4.
e) Vodnevі spoluki:
CH4; SiH 4, GeH 4. SnH 4, PbH 4. Metāns - CH 4 - mitsne z'єdnannya, silāns SiH 4 - mensh mitsne z'єdnannya.
Shēmas oglekļa un silīcija atomu attīstībai, piemēram, piemēram, jaudā.
З lS 2 2S 2 2p 2;
Si 1S 2 2S 2 2P 6 3S 2 3p 2.
Ogleklis un silīcijs ir nemetāli, jo uz jaunākās elektroniskās lodītes ir 4 elektroni. Ale, tā kā silīcijs ir lielāks atoma rādiuss, tad jaunākam ir pieejama tipiskāka elektroenerģija, nevis ogleklim. Vuglets - svins:
Zavdannya. Kā atnest, kā grafīts un dimants ir alotropiski viena un tā paša ķīmiskā elementa ziņā? Kurš var izskaidrot varas iestāžu viedokli?
Lēmums. І dimants, grafīts, aizdedzinoties skābā, oksīdu pārvērš ogleklī (IV) C0 2, izlaižot caur ūdeni, vipadє nogulsnēs kalcija karbonāts CaCO 3
Z + 0 2 = CO 2; C0 2 + Ca (OH) 2 = CaCO 3 v - H 2 O.
Turklāt dimantu var nogriezt no grafīta, kad tas tiek uzkarsēts augstās skrūvspīlēs. No tā paša laika, līdz noliktava un grafīts, un dimants ir iekļauti tikai ogles. Grafīta un dimanta jaudas atšķirība ir izskaidrojama ar atšķirību kristāla režģī.
Kristāla šķīdumos dimantam ir āda uzņēmuma izplūdes ogleklī. Atomi ir rostēti ar vienu un to pašu izcelsmi, viens no viena un vēl vairāk piparmētru sasaistīts kopā ar kovalentām saitēm. Tsim izskaidros dimanta lielo cietību.
Grafītam ir atomi ogleklī ar paralēlām bumbiņām. Izkāpiet starp piekārtām bumbiņām lielākā mērogā, zemāk starp piekārtiem bumbas atomiem. Skaņai starp bumbiņām pievienošu skaņas sīkumu, un grafītu ir viegli sadalīt plānos gabaliņos, kas ir vēl mikroskopiskāki.
Z'єdnannya z vodnem, scho tweak in charcoal. Empīriskās formulas, atomu hibridizācijas veids ogleklī, valence un ādas elementa oksidācijas stadijas.


Oksidācijas posms vairumā gadījumu ir +1.
Ceļa valence ir viena, ogļu valence ir izvēle.
Stipra un silīcijskābes formulas, ķīmiskā jauda, samazinot līdz metāliem, oksīdiem, pst., Īpatnējā jauda.
H 2 CO 3 - vugilīnskābe,
H 2 SiO 3 - silīcijskābe.
H 2 CO 3 - іsnu tilki diapazonā:
H 2 C0 3 = H 2 O + C0 2
Н 2 SiO 3 ir cieta upe, kas praktiski nenožēlo ūdeni, tāpēc ūdens katjoni ūdenī praktiski nesadalās. Saiknē ar cym ir arī spēcīgs skābju spēks, jo attiecībā uz indikatoru H 2 SiO 3 nevar ietekmēt, tas ir pat vājāks par spēcīgu skābi.
Н 2 SiO 3 - ne -triviāla skābe; karsējot tā pakāpeniski izplešas:
H 2 SiO 3 = Si0 2 + H 2 0.
Н 2 CO 3 reaģē ar metāliem, metāla oksīdiem, apakšnodaļām:
a) H 2 CO 3 + Mg = MgCO 3 + H 2
b) H 2 CO 3 + CaO = CaCO 3 + H 2 0
c) H 2 CO 3 + 2NaOH = Na 2 CO 3 + 2H 2 0
Ogļskābes ķīmiskā jauda:
- 1) spirta skābes,
- 2) īpatnējā jauda.
Pierādījumi, kas apstiprina pamatotās reakcijas.
1) reakcija ar aktīvajiem metāliem:

Zavdannya. Turklāt silīcija oksīda (IV), kalcija karbonāta un barotnes, kas ir summas pēdējā sastāvdaļa, ķīmiskā atjaunošana. Aprakstiet dienas beigas.
Lēmums.
1) līdz pilnīgai sālsskābes uzplūdam.
stundu plāns
IV A grupas elementu sākotnējās īpašības.
Ogleklis un silīcijs
meta:
pārklājums: formulēt stipendijās piemājas par elementiem, kas jāiekļauj noliktavā 4 - galvenā spēka grupa, dzīvīgums, pievērsiet uzmanību bioķīmiskajai lomai un dienas galveno elementu uzglabāšanai.
attīstās: Lai izstrādātu rakstīšanas un rakstīšanas padomus, ziņas, vēstules, vikoristovuvati otrimanі zināšanas jaunajiem uzņēmumiem.
vihovuє: vikhovati gandrīz patērē jaunās zināšanas.
Iet uz nodarbību
Šķērsoto atkārtošanās:
Cik elementu tiek izmantoti pirms nemetāliem? Vai vēlaties, lai tas būtu PSKHE?
Kādi ir organogēnā satura elementi?
Ieviest moduļu dzirnavas visiem nemetāliem.
Kādas ir nemetālu molekulas?
Vai oksīdus sauc par neveidojošiem sāli? Uzrakstiet formulas nemetālu oksīdiem, kas neveido sāli.
Cl 2 → HCl → CuCl 2 → ZnCl 2 → AgCl
Atlikušā rivnyannya reakcija tiek reģistrēta jonu viglādē.
Pievienojiet šādas iespējamās reakcijas:
1) H 2 + Cl 2 = 6) CuO + H 2 =
2) Fe + Cl 2 = 7) KBr + I 2 =
3) NaCl + Br 2 = 8) Al + I 2 =
4) Br 2 + KI = 9) F 2 + H 2 =
5) Ca + H 2 = 10) SiO 2 + HF =
Ierakstiet rivnyannnya reakcijas slāpekļa mijiedarbībā ar a) kalciju; b) ar ūdeni; c) skābs.
Zd_ysniti lantsyuzhok perversija:
N 2 → Li 3 N → NH 3 → NO → NO 2 → HNO 3
Kad saskaņā ar reakciju NH 4 NO 2 = N 2 + 2 H 2 O tika sadalīts 192 g amonija nitrīta, tika pievienoti 60 litri slāpekļa. Zināt produkta veidu ir teorētiski iespējams.
Vivchennya jauns materiāls.
Līdz 4 A grupai ir p-elementi: ogleklis, silīcijs, germānijs, alva un svins. Atkarībā no energoiekārtu skaita atomi bez sprieguma var atrasties ceturtajā elektroapgādē. Pievienojoties grupas pieaugumam no augšas uz leju, saglabāto elektronisko bumbiņu skaits un atoma lielums. Olbaltumvielu oglekli un silīciju bieži iegūst no visu elementu spēka. Visu veidu nemetāli. Ģermānim ir metāla zīmes, un alvai un svinam ir smaka pār nemetāla zīmēm.
Dabā kokoglēs Kļūsti par dimantu un grafītu nometnē. Zm_st oglēs zemes garozā kļūst tuvu 0,1%. Vin, lai ieietu dabisko karbonātu noliktavā: vapnyak, murmulis, kreidijs, magnezīts, dolomīts. Vuglets є galva noliktavas daļa organiska runa. Vugilla, kūdra, ligroīns, koksne un dabasgāze var tikt uzskatīta par degvielu, lai tā ugunsgrēkā apstātos.
Fiziskā jauda. Vuglets jaks ir vienkāršs vārds alotropu formu lokā: dimants, grafīts, karabīns un fullerēns, ko var ātri attīstīt Fiziskā jauda, Es paskaidrošu sevi kristāla režģu pumpuriem. Karbins - smalki kristālisks pulveris melnā krāsā, pirmo reizi 60. gados sintezēja Radianskas ķīmiķi, ņemot vērā zināšanas par dabu. Uzkarsējot līdz 2800º bez piekļuves, pārvēršas par grafītu. Fullerēns - 80. gados bumbiņas sintezēja sfēriskas struktūras, kuras noteica oglekļa atomi fullerēni. Smarža ir slēgta struktūra, kas sastāv no vienskaitļa atomu skaita oglēs - Z 60, Z 70.
Jautras autoritātes.Ķīmiski sajauktajās oglēs ar saprātīgi prāti inerts. Reakcijas ātrums pielāgosies pielāgotajai temperatūrai. Augstās temperatūrās ogles sajauc ar ūdeni, skābu, slāpekli, halogēniem, ūdeni un dažiem metāliem un skābēm.
Kad ūdens likme tiek izvadīta caur vougillas savienojumiem, no koksa jāiznīcina oglekļa (II) un degvīna oksīda daudzums:
C + H 2 O = CO + H 2 (tvaiks),
Reakcija notiek pie 1200º, temperatūrā, kas zemāka par 1000º, oksidācija tiek veikta līdz CO 2 :
З + 2H 2 O= CO 2 + 2 H 2 .
Svarīgs Promislovo process: ūdens gāzes pārvēršana metanolā (metilspirtā):
CO + 2H 2 = CH 3 ВІН
Ar augstu temperatūru ogļu ēkā injicējot metālus, karbīds, to vidū nogulumu klātbūtnē redz "metānu" un "acetilēnu", kas gāze ir redzama, mijiedarbojoties ar ūdeni vai skābi:
Sas 2 + HCl = CaCl 2 + C 2 H 2
Al 4 C 3 + 12 H 2 O = 2 Al(Ak) 3 ↓ + 3 CH 4
Tā ir lieliska praktiska vērtība kalcija karbīdam, ko var izmantot CaO un koksa sildīšanai elektriskajās krāsnīs bez piekļuves pārtikai:
CaO + 3C = Sac 2 + CO
Kalcija karbīda vicorists acetilēna noraidīšanai:
Sas 2 + 2 H 2 O= Ca (OH) 2 + C 2 H 2
Tomēr attiecībā uz oglēm raksturīgajām reakcijām, kurās vīni uzrāda neparastu jaudu:
2 ZnO + C = Zn+ CO 2
CKonsolidācija oglēs.
Oglekļa oksīds (CO) ir netīra gāze. Rūpnieciskā līmenī ir nepieciešams izdalīt ejas oglekļa dioksīdā virs vugіllas cepšanas plkst. paaugstināta temperatūra... Laboratorijas izlietnēs CO sildot var izdalīt sērskābes un ērkšķogas skābes koncentrāciju (sērskābe ir ūdens):
NSOOH =H 2 O+ CO
Oksīds ogleklī (CO 2) - oglekļa dioksīda gāze. Oglekļa dioksīda atmosfērā nedaudz 0,03% no svara vai 0,04% no svara. Nodrošiniet vulkāna un karstās dzherelas atmosfēru, un, nareshty, cilvēki dedzina degošus kopalīni. Atmosfēra visu stundu mainīja gāzes ar okeāna ūdeni, piemēram, atmaksājot 60 reizes vairāk oglekļa dioksīda, mazāk atmosfēras. Šķietami, oglekļa dioksīda gāze ir piemērota miegainām promenādēm spektra infrasarkanajā reģionā. Tims pats izslēgs oglekļa dioksīda gāzi siltumnīcas efekts un regulēt globālo temperatūru.
Laboratorijas izlietnēs oglekļa dioksīda gāzi attīra ar sālsskābi murmurim:
CaCO 3 + 2 HCl = CaCl 2 + H 2 O+ CO 2
Oglekļa dioksīda spēks neizraisa ugunsgrēku rašanos citos pielikumos. Mainot saķeri, oglekļa dioksīda atšķirība strauji pieaug. Kopumā gruntējums jāņem no gāzētiem dzērieniem.
Vugilskābe šķīdumā nav vēlama. Sildot, starpība tiek nogulsnēta uz oksīda ogleklī un ūdenī. Skābes sāļi ir stīvi, ja pati skābe ir nestabila.
Najvazhliyu reakcija uz karbonātu - jonu є minerālskābju atšķaidīšana - sālsskābe vai sirchanoi. Ar daudziem ērkšķiem sīpoli ir redzami oglekļa dioksīdā, un, to izlaižot caur šķīdumu, kalcija hidroksīds (ūdens) ir duļķains kalcija karbonāta apstiprinājuma rezultātā.
Silīcijs. Rakstot populārāko elementu uz Zemes. Laimē, lai kļūtu par 25,7% no masalu masas. Ievērojamo daļu attēlo silīcija oksīds, ko sauc silīcija dioksīds, Yaky, lai būtu redzams trases vai kvarca redzeslokā. Ļoti tīrā viglādē silīcija oksīds aug viglādas minerālā, ko sauc girskiy kryshtal. Kristāliskais silīcija oksīds, kas izgatavots ar nelielām mājām, izveidoja dārgus akmeņus: ahātu, ametistu, jašmu. Іnsha dabas resursu grupa silikona silikati izgatavošanai - pazudusi silīcijskābe.
Rūpnieciskajam silīcija dioksīdam to apstrādā ar koksu elektriskajās krāsnīs, lai iegūtu jaunu silīcija oksīdu:
SiO 2 + 2 C = Si + 2 CO
Laboratorijās kā priekšgājēji ir magnijs vai alumīnijs:
SiO 2 + 2Mg = Si + 2MgO
3 SiO 2 + 4Al = Si + 2Al 2 O 3 .
Lielāko daļu tīra silīcija iegūst, reducējot silīcija tetrahlorīdu ar cinka tvaikiem:
SiCl 4 + 2 Zn = Si + 2 ZnCl 2
Fiziskā jauda. Kristāliskais silīcijs ir tumši pelēkas krāsas kriķis ar tērauda liesmu. Silīcija struktūra ir līdzīga dimanta struktūrai. Silīcija vikorists gida kvalitātē. Mēs esam tā saukti miegainas baterijas, Zdatnі pārveido svіtlovu enerģiju elektrībā. Silīcija ļaunums metalurģijā silīcija tērauda noņemšanai, kas ir ļoti izturīgs pret karstumu un skābēm.
Jautras autoritātes. Aiz silīcija ķīmiskajām spējām, piemēram, akmeņoglēm, є nemetāla, ale nemetāliskuma, tas šūpojas vājāk, tāpēc atomu rādiuss ir lielāks.
Silīcijs ar ekstravagantiem prātiem ir elegants, lai iegūtu enerģiju. Bezposeredno vzaєmodіє tіlki ar fluoru, kausējot fluorīdu ar silīciju:
Si + 2 F 2 = SiF 4
Skābes (izņemot fluorūdeņraža HF un slāpekļa daudzumu) neietilpst silīcijā. Ale vin raschinyaєtsya hidroksīda metālos:
Si + NaOH + H 2 O = Na 2 SiO 3 + 2H 2
Augstās temperatūrās elektriskajā krāsnī ar pārtikas un koksa daudzumu izmantojiet silīcija karbīdu SiC- karbons:
SiO 2 + 2C =SiC+ CO 2
Slīpēšanas akmeņi un slīpēšanas apļi ir izgatavoti no silīcija karbīda.
Tiek saukti metālu spoli ar silīciju silikīds:
Si + 2 Mg = Mg 2 Si
Lietojot magnija silikīdu ar sālsskābi, izmantojiet vienkāršāko silīcija šķīdumu silāns -SiH 4 :
Mg 2 Si+ 4 sl = 2 MdCl 2 + SiH 4
Silan ir aizskaroša gāze ar nepieņemamu smaku, kas no rīta aizdegas.
Z'єdnannya krama. Silikona dioksīds- cieta ugunsizturīga upe. Dabā pagarinājumi divos veidos kristālisks un amorfs silīcija dioksīds. Silīcijskābe- є vāja skābe, karsējot, to ir viegli nogulsnēt uz ūdens un silīcija dioksīda. Jūs varat būt arī otrimans jaks želejveida masas viglādī, lai atriebtos par ūdeni, kā arī koloidālā roša (sol) viglādī. Silīcijskābes sāļi zvanu pats silikatami. Dabiskā jauda - lai nokļūtu salokāmajos spolumos, no noliktavas var redzēt attēlu decila oksīdu rezultātā. Tilki silikati soda un kalorijas ūdenī. Nameх nosaukums ar šūpojošu nogāzi, un їх atšķirības - reta nogāze.
Zavdannya par zakr_plennya.
2. Pievienot vienkāršo reakciju motīvus, pabeigt uzdevumu.
| 1 komanda
| 2 komanda
| 3 komanda
|
| H 2 SO 4 + HCl - | CaCO 3 +? -? + CO 2 + H 2 O |
|
| NaOH + H 2 SO 4 - | CaCO 3 + H 2 SO 4 - | K 2 SO 4 + CO 2 + H 2 O - |
| CaCl 2 + Na 2 Si O 3 - |
||
| Si O 2 + H 2 SO 4 - | ||
| Ca 2+ + CO 3 -2 - | CaCl 2 ++ NaOH - |
|
| zavdannya: Kad oksīds (111) tika ievadīts akmeņoglēs, tika noņemts 10,08 g zelta, kas zaudēja 90% no teorētiski iespējamās ražas. Jaka masa ņemta līdz oksīda zalizam (III)? | zavdannya: Cik daudz silikāta nātrija, leģējot ar silīcija (IV) oksīdu no 64,2 kg nātrija, kāpēc vajadzētu noņemt 5% no mājas? | zavdannya: Ar sālsskābi uz 50 g kalcija karbonāta tika ņemti 20 g oksīda oglekļa (IV). Kāda veida oksīds oglekļa (IV) (%) teorētiski sūnveida? |
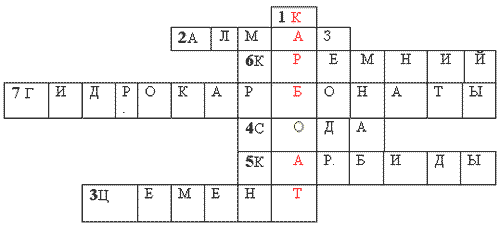
Krustvārdu mīkla.
NSpar vertikāli: 1. Ogļskābes smails.
Horizontāli: 1. Cietākā dabiskā runa uz Zemes. 2. Izglītības materiāls. 3. Rechovina, jaku ieskaite testa sagatavošanai. 4. Z'єdnannya silīcijs ar metāliem. 5. Galvas pidgrupas 1V grupas PS elements ķīmiskie elementi... 6. Ogļskābes sāļi, kas palīdz atriebties ūdenim. 7. Dabiski z'єdnannya silīcijs.
Mājasdarbs: 210. – 229. puse.
Tēma:IV-A grupas elementu sākotnējās īpašības.
Jaudīgums.
meta : Apskatiet elementu IV-A grupu īpašības uz muca ogles un silīcija; šo elementu fizikālo un ķīmisko spēku, sniedzot izpratni par "absorbciju".
apgaismojums : lasīt zinātnieki patstāvīgi zdobuvati zināšanas racionāla Viktorijaіznіkh dzherel іnformatsії (apstrādātāji, zinātniski populāra literatūra) і zastosovuvati іtrimanі zināšanas; Izveidot cēloņsakarību - iedzimtu saikni starp Budvas iedzīvotājiem, varas iestādēm un runas vēsturi, pamatojoties uz izglītības teorijām, publicitāti un zinātnieku zināšanu sistematizāciju par oglekli un silīciju cilvēku vēsturē;
Attīstās : skolēnu izglītojošās intereses attīstīšana, prātā redzēt galvu, to izvilkt, izmantot, loģiskā domāšana;
vikhovuvati veselīga uzvedība klasē.
ustatkuvannya: Dators, prezentācija, apstrādātājs, tabula "Ķīmisko elementu periodiskā sistēma"
Iet uz nodarbību:
1. Organizatoriskais moments.
2. Pārbaudiet mājas darbus.
3. Pamatzināšanu realizācija
(Priekšējā daļa).
Nosauciet iepriekš ievadāmos vienumusIVgrupa.
Nosauciet vienumus ar pidgroupIVgrupējums.
4. Jauna materiāla izpēte.
Ķīmisko elementu periodisko sistēmu stāvoklis, atoma C budova,Si
skolotājs ... Hops, brīnīsimies periodiskā sistēmaķīmiskie elementi, un ir svarīgi, lai tie ietvertuEsV-A pidgroup?
Vidpovida zinātnieks.
Grupas galvgalīEsV-A gr. Ievadot vienumus:C, Si, Ge, Sn, Pb-
C, Si, Ge - nemetāli - Sn, Pb - metāli
skolotājs ... Kas spіlnogo Budovі atomsіv cikh elementos?
( robots mācās mazulim )
1. Vuglets
6 C) 2) 4
…2 s22 lpp2
2. Silīcijs
14 Si) 2) 8) 4
…3 s23 lpp2
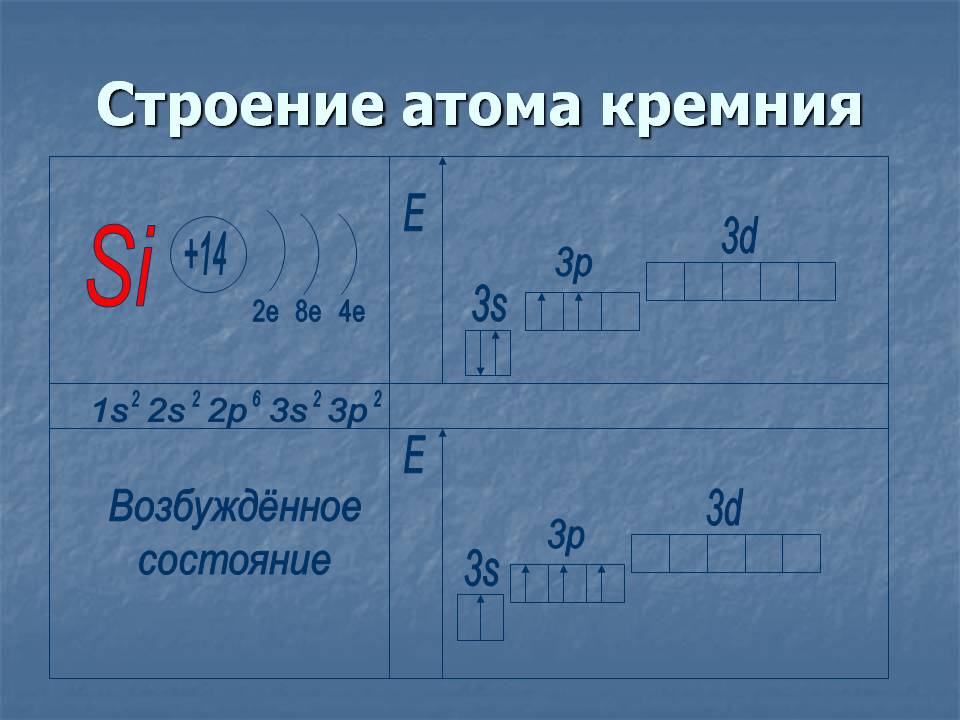
novērtējis zinātnieks ... Vai tas pats budovu atoms (pēdējā rіvnі 4e).ns 2 np 2 un valenceII, IV
Skolotājs. Kā jūs pretojaties elementu spēkam no lielajiem?
novērtējis zinātnieks ... Metāla jaudas pieaugums aug metāla izaugsmē, bet nemetāla jaudas izmaiņas.
skolotājs ... Yaki vischі oksīdi un apstiprināt 1V-A grupas elementus?
novērtējis zinātnieks ... Konfigurējiet vischі oksīdu veidu -RO 2 ( robots uchnya bіlya doshki ) CO 2, SiO 2 Ge O 2 SnO 2 PbO 2
Skolotājs. Jaka peld ūdens spoluki uzstādīt elementus?
Vidpovida zinātnieks. Lidojošā ūdens tipsRH 4 ( CH 4 , SiH 4 )
Skolotājs. Oglē es iestatīšu 2 allotropās sugas: grafītu, dimantu
Tabula "Budova kristāla režģi dimantam un grafītam"
allotropija ogleklī
grafīts
dimants
Fiziskā jauda
tumši pelēks, vadiet elektrisko plūsmu un sildiet
Prozore ir kristāliska cieta runa ar raksturīgu mirkšķināšanu.
t = 1420 kušanas; nevadiet elektrisko strāvu un siltumu
Robots grupās ar rokudzelžiem. Apmainīties ar informāciju. Ieraksts Zoshitā.
1. grupa 1. grupa
Z
Si
zināšanas dabā
CaCO pakāpe 3 murmina dimants
grafīts
malahīts CuCO 3
ligroīns
27% Zemes masalu - SiO sula 2
Jautras autoritātes
C + 2H 2 → CH 4
C + O 2 → CO 2
3 C +4 AL → AL 4 C 3
Ca + 2C → CaC 2
2 AL 2 O 3 + 3C → 4AL + 3CO 2
Si + O 2 → Si O 2
Si + 2CL 2 → SiCL 4
Si + 2Br 2 → SiBr 4
2Mg + Si → Mg 2 Si
nepieredzējis
urbji, sklorizi, dzirnaviņu pulveris, dārgi akmeņi,medicīniskā alkohola tīrīšana no fūzeļa eļļām
tsukru attīrīšana pārstrādes rūpnīcās no rechovins, kas ražo youma zhovty kolir
pamatojoties uz koka vuglas adsorbcijas spēku krievu ķīmiķis Mikola Dmitrovičs Žeļinskis salauza filtra gāzi
(Budovi filtru kastīšu demonstrācija Protigaz).
Nodrošinātājs (miega baterijas)
tērauds
modinātājs
Adsorbcija-– laba gāzes kvalitāte un runas atpazīšanauz cietā ridini ķermeņa virsmas(Caur porainu budovi tila).
Uztura problēma: vai adsorbcija ir fizisks vai ķīmisks process?
Demonstrācijas dosvid "Adsorbcija".DOSVID: Līdz zilā lakmusa beigām, lai pilnveidotu vugilla aktīvus. Vidfіltruvati otrimanu sumіsh. Filtrats ir absolūti iespaidīgs.
VIDPOVID : fiziski, kas nemaina runas noliktavu
5 Sistemātiskas un sabiedrības zināšanas
Zdіysnіt pārskatīšana. Uzrakstiet reakcijas kopsavilkumu.
CH 4 ← C → CO → CO 2 → H 2 CO 3
CaC 2
refleksija
Jak vi vvazhaєte, kāpēc mūsu stunda tiek pasniegta?
Vai jūs vēlētos redzēt vikontu vairāk reižu, bet vai jūs to būtu spēlējis citādi?
Vai esat redzējuši pozitīvas emocijas no šī gada nodarbības?
6. D / s
Pirms grupas noliktavas ir 5 elementi: divi nemetāli-ogleklis un silīcijs, kas atrodami Mendeļa sistēmas otrajā un trešajā periodā, un 3 metāli-Nimechchin (starpposms starp nemetāliem un metāliem, alva un svins IV, VI. Visiem šiem elementiem ir raksturīgi, ka simts smaržo pēc jaunā 4 elektronu enerģijas līmeņa. Turklāt ir iespējams parādīt oksidācijas soļus no +4 līdz -4. 4, PbН 4. sildot darba dienā, atbrīvojieties no pārtikas, ūdens un halogēnu elementiem.
Oksidācijas pakāpe +4 izdziest, kad 1s-elektroni tiek pārnesti uz vertikālo p-orbitāli. Palielinoties atoma rādiusam, mainīsies savienojums starp zvana elektroniem un kodolu. Nemetāliskais spēks mainīsies, bet metāls augs. (Kušanas temperatūra, viršanas temperatūra utt.) Samazinās
alva nav atrodams līdz plaši izplatīto metālu skaitam (nevis 0,04% zemes garozā), to ir diezgan viegli izkausēt no rūdām, un tas ir kļuvis par SUNNY tautu sakausējumu redzeslokā kopš pusdienlaika (bronzas) kopš seniem laikiem reizes. Redzams skābes spolukas SnO 2 (skārda akmens, no kura doties papildu atjaunināšanai) redzeslokā. Viļņa dzirnavās alva ir zīdaini smilškrāsas metāls. Ar skārda skārda nūju jūs varat sajust kristālu režģu raksturīgo raustīšanos pa vienam.
Alva ir mīksta un viskoza, un to var viegli sarullēt plānās loksnēs, ko sauc par alvas foliju vai stanilu.
Krim zychany balta skārda, Tas kristalizējas tetragonā, ja tas ir mazāk kā alvas veids - kungs alva Kristalizējieties kubiskā sistēmā un dodiet mazāk jaudas. Vairāk alvas ir stabila temperatūrā, kas augstāka par 14 ° C, un tēvs - temperatūrā, kas zemāka par 14 ° C, tāpēc, atdzesējot, alva tiek pārveidota par tēvu. Pie zv'yaznuyu zі zіnuyu znіnoy znіnoyu sіlnosti metāla, kad tsyomu rassipayetsya pelēkā pulverī. Es šo fenomenu nosaukšu par alvas mēri. Visu baltās alvas transformāciju labāk sildīt temperatūrā, kas ir tuvu 30 ° C; kļūst ātrāks pelēkas alvas kristālu dīgļu klātbūtnē.
Sakausējiet alvu ar virsmu un ļaujiet tai sasalt, lai sagatavotu gultņus. Tsi saplūšana (alvas babiti) ar augstu pretestības spēku. Alvas sakausējumi ar svinu - pripіy - tiek plaši izmantoti lodēšanai. Leģējošā komponenta alvas jaka ir iekļauta midi sakausējumos. Istabas temperatūrā alva istabas temperatūrā neoksidējas, bet pakāpeniski to uzkarsē līdz kušanas temperatūrai, lai pārvērstos alvas dioksīdā. Alvam netiek izmantots ūdens SnO2. Pievieno sālsskābi un pievieno vēl vairāk. Koncentrēta skābe, sasildot, sadala alvu.
Sn + 2 НСl = SnСl 2 + Н 2 #
Sn + 4H 2 SO 4 = Sn (SO 4) 2 + 2 SO 2 # + 4H 2 O
Koncentrētāka slāpekļskābe, intensīvāka reakcija
4Sn + 10 HNO 3 = 4Sn (NO 3) 2 + NH 4 NO 3 + 3H 2 O
Sn + 4 НNО 3 = Н 2 SnО 3 $ + 4NО 2 # + Н 2 О koncentrācijā
Koncentrētas pļavas reaģē Sn + 2NaОН = N а 2 SnО 2 + Н 2 #
Na 2 SnO 2 Kļūsti par nātriju. Pie razchina sāļi hidratēts (otocheni ar ūdens molekulām). No otras puses, pārklājiet alvu ar izārstētu plavkoy. Alvas komplekta komplekss Nolu 2
Kārbu ražošanā tiek atrasts 40% alvas. Zalizo ir pārklāts ar alvu. Alva tiek izmantota, lai iestatītu stiyki spoluks ar oksidācijas soļiem +2, +4.
SnО (II) -govty pulveris, iet, atverot Sn (ОН) 2 -amfoteriskais hidroksīds Sn (ОН) 2 + 2
Alvas dioksīds ir atrodams dabā. Apstipriniet, kad no rīta guļat Sn.
Alvas skābe Н 2 SnО 3 nešķīst (bilija pulveris) kopā ar pļavām Н 2 SnО 3 + 2 NaOH + Н 2 О = N а 2
Alvas hlorīds, sārts SnCl 2, alvas hidrīds SnH 4, bezkrāsains, pat izplūdes gāze.
Svins. Rūdas. Neatkarīgi no tā, kāds svins tiek noņemts, to sauc par svina bliksu.
PbS + 3О 2 = 2PbО + 2SО 2 - grauzdēšana.
Lai izkausētu PbO kopā ar koksu un noņemtu svinu, un pēc tam to notīrītu.
Svins ir svarīgs metāls. Vīns ir mīksts un smejas ar nazi.
Svins tiek plaši izmantots tehnoloģijās. Lielākā daļa vitamīnu ir nepieciešami kabeļu apvalku un bateriju plākšņu sagatavošanai. Svinu izmanto, lai sagatavotu munīciju un šāvienu. Vin ieiet bagatokh sakausējumu noliktavā (gultņi, drukarsky fonts, lodēt). Svins ir labs g - viprominuvannya un vikoristovuyutsya to sagūstīšanai ar robotiem ar radioaktīvām runām.
Dažreiz tas ir viegli oksidējams un pārklāts ar oksidētu oksīdu, ko var novākt oksidācijas rezultātā. Ūdens netraucē svinu, bet drīzāk postoša dzēriena klātbūtnē. 2Pb + О 2 + 2Н 2 О = 2Pb (ОН) 2
Kad esat iestrēdzis ar raupju ūdeni, saritinieties ar plānu šķīvi ar nejutīgiem sāļiem un nesadrupiniet.
Atšķaidīts ar sālsskābi un sirhanskābi un var nereaģēt ar svinu. Ar koncentrētu skābi, karsējot, ievadiet Pb (HSO 4) 2.
Ar atšķaidītu slāpekļskābes reaģentu pazeminiet ar koncentrētu. mijiedarbība ar pļavām Pb + 4КОН + Н 2 О = К 4 + Н 2 # hidroksoplumbīta kalija.
Oksidācijas stadijas ir raksturīgas +2, +4
PbО = - zhovty pulveris, cepts (500 ° C), uzbriest sarkanā košļā krāsā un tiek saukts par litharge.
Svina hidroksīds Pb (OH) 2 amfoterisks.
Pb (OH) 2 + 4 NaOH = 2 Na
Ja Pb (OH) 2 ir sakausējumi, sausās pļavās parādās plūmju sāļi:
Pb (OH) 2 + 2 NaOH = N а 2 PbО 2 + 2Н 2 О
Svina acetāts tiek stabilizēts pie farbuvanny Pb (СН 3 СОО) 2
PbS - melna krāsa. Tētis, zmocheniya razchin soli svins, shvidko tumšs, kā pasaulē є sirwater. Tse yak_sna reakcija uz sālsūdeni. Spoluki svins (IV) -Sil plumbati CaO + PbO = Ca PbO 3
Akumulatori tiek uzglabāti mazos svina plākšņu gabalos, viens piepildīts ar svina dioksīdu, bet - ar metāla sūkļainu svinu. Plāksnes ir urbtas 35-40% robežās Н 2 SO 4. ar robota ID, izlāde: Pb + SO 4 2- ® PbSO 4 $ + 2е
Metāla svins tiek oksidēts, un svina dioksīds tiek atjaunots.
PbО 2 + SO 4 2 - + 4Н + ® Pb SO 4 $ + Н 2 О
Elektroni, kurus vada svina atomi, tiek pārraidīti pēdējā lance. Pb ir anods, un PbO 2 ir katods. H 2 SO 4 gadījumā tiek novērota jonu pārnešana. Ioni SO 4 2- - sabrūk līdz anodam, H + - līdz katodam.








