Sirkhoven sirchisny gāze. otrimannya sirkovodnyu
VĒRTĪBA
sirvodden Tā ir gāze bez bariem ar raksturīgu sapuvušas pudeles smaržu.
Laika apstākļiem ir ļoti svarīgi paaugstināties temperatūrā -60,3 o С un smagāk pie -85,6 o С.
2H 2 S + 3O 2 = 2H 2 O + 2SO 2.
Ja ūdens pusē ievedat kādu aukstu priekšmetu, piemēram, porcelāna krūzi, tad uz pusi ievērojami samazinās temperatūra un ūdens tiek oksidēts tikai nedaudz pelēkā krāsā, pēc tam nosēžas uz bļodas, ņemot vērā saldūdeni:
2H 2 S + O 2 = 2 H 2 O + 2S.
Sirevodn ir viegli aizdedzināt; joga summa ar lieciniekiem pіdrivaє. Sirvodden ir vēl sazarota. Trivale zithannya povitrya, kā atriebties par visu gāzi, lai navitētu nelielos daudzumos, wiklikak svarīga bārkstis.
Pie 20 o Ar vienu tilpumu ūdens razchinyaє 2,5 obsyagu sirvodnyu. Rožčins sirvodnu pie ūdens, ko saukt ar ūdeni... Stāvot uz pagriezieniem, īpaši uz gaismām, sirkovodneva vodi Drīz no tām atskanēs sirēnas. Tse vіdbuvaєtsya oksidēta ūdens rezultātā skābā ūdens.
otrimannya sirkovodnyu
plkst paaugstināta temperatūra sirka vzaєmodin s vodnem, fiksējošā gāze sirvodin.
Praktiski ūdeni var izmantot divu skābju atšķaidījumu izšķīdināšanai uz sausa metāla, piemēram, sulfīda zalīzā:
FeS + 2HCl = FeCl 2 + H 2 S.
Tīrāku ūdeni var iegūt ar hidrolīzi CaS, BaS vai A1 2 S 3. Tīrāku gāzi iegūst, tiešā ūdens un ūdens reakcijā 600 ° C temperatūrā.
Spēka ķīmija
Razchin sіrvodnuyu vіdі mak vіdlivostі skābe. Sirwater ir vāja divskābes skābe. Vona disociācijas posms bieži un galvenokārt pirmajā posmā:
H 2 S↔H + + HS - (K 1 = 6 × 10 -8).
Disociācija citā līmenī
HS - ↔H + + S 2- (K 2 = 10-14)
skaitītājs mazajā mazajā pasaulē.
Sirvodden ir spēcīgs līderis. Ja spēcīgi oksidējoši vīni tiek oksidēti līdz sēra dioksīdam vai sērskābei; oksidēts glikīns, kas jānovieto pēc notekas veida: temperatūra, pH diapazons, oksidētāja koncentrācija. Piemēram, reakcija ar hloru ir reakcija uz sālsskābes veidošanos:
H 2 S + 4Cl 2 + 4H 2 = H 2 SO 4 + 8HCl.
Vidējos sāļus sauc par sulfīdiem.
zasosuvannya sirvodnya
Zastosuvannya sirkovodnya dosit ir savstarpēji saistīts, labi, pirmkārt, tas ir saistīts ar augstu toksicitāti. Iegūt zināšanas par uzglabāšanu laboratorijas praksē kā svarīgu metālu izgulsnētāju. Kalpo kā syruvina, lai noņemtu sirshīnskābi, ūdeni elementārā viglādā un sulfidiv
Uzstādiet uzdevumus
1. PIELIKUMS
| zavdannya | Pārliecinieties, ka H 2 S ir nedaudz svarīgāks ūdens. |
| Lēmums | Gāzei dotās masas izmaiņas tajā pašā sistēmā ņemtajā gāzes masā, tajā pašā temperatūrā un tajā pašā netikumā, sauc par pirmās gāzes pieļaujamo jaudu pēc otras. Tiek parādīts displeja lielums, kurā pirmā izstrādātā gāze ir svarīgāka vai vieglāka nekā otra gāze. Parastā molekulmasa tiek uzņemta vismaz 29 (ar urahuvannyy zmystu in vitro slāpekli, skābām un citām gāzēm). Slīdēja, lai nozīmētu, ka izpratne par "dzēriena apbrīnojamo molekulmasu" pierod garīgi, kā arī gāzes labestība. D gaiss (H 2 S) = M r (H 2 S) / M r (gaiss); D gaiss (H 2 S) = 34/29 = 1,17. M r (H 2 S) = 2 × A r (H) + A r (S) = 2 × 1 + 32 = 2 + 32 = 34. |
| vidpovid | Sirēna H 2 S ir svarīga pagriezienam 1,17 reizes. |
2. PIELIKUMS
| zavdannya | Ziniet prasmes, kas slēpjas aiz gāzes ūdens plūsmas, kurā apgabala tilpumā skābums kļūst par 20%, ūdens saturs - 40%, ūdens līmenis - 40%, ūdens līmenis ir H 2 S. |
| Lēmums | Dažas gāzes daļas tiks izkaisītas ar molāriem, tobto ar upju skaita daļām, mantojuma cenu no Avogadro likuma. Es zinu, kā notīrīt summas molekulmasu: M r nosacīts (maisījums) = φ (O 2) × M r (O 2) + φ (H 2) × M r (H 2) + φ (H 2 S) × M r (H 2 S); |
| Parametra nosaukšana | vērtību |
| Raksta tēma: | sirvodden |
| Kategorija (tematiskā kategorija) | Metāls un metināšana |
otrimannya sіrki
Jautras autoritātes sirki
Istabas temperatūrā ūdens nonāk reakcijā tikai ar dzīvsudrabu. Pielāgojot temperatūru, aktivitāte ievērojami palielinās. Sildot, sirka reaģē bez vidus ar vienkāršām frāzēm, vainojot inertās gāzes, slāpekļa-sil-en, teluru, zelta-platīna, irīdija un joda. Sulfīda slāpekli un zeltu noņem netieši.
- Iesaistīšanās metālos
syrka šovs spēka oksidēšana, Mijiedarbības rezultātā tiek noteikti sulfīdi:
- Vzaєmodia ar ūdeni vārīt 150-200 ° C temperatūrā:
H 2 + S = H 2 S.
- Vzaєmodiya z kisnem
Ūdens deg skābē 280 ° C temperatūrā, savukārt 360 ° C temperatūrā, pie kura tiek iestatīta oksīdu summa:
S + O 2 = SO 2;
2S + 3O 2 = 2SO 3.
- Kombinācija ar fosforu un oglēm
Sildot bez piekļuves elektrībai, ūdens reaģē ar fosforu, oglekli, parādot oksidācijas spēku:
2P + 3S = P 2 S 3;
- Kombinācija ar fluoru
Spēcīgu oksidētāju klātbūtnē izpaužas šāda jauda:
S + 3F 2 = SF 6.
- vzaєmodiya zі saliekot vārdus
Sazinoties ar saliekamiem syrka vārdiem, jūs sauksiet par galveno:
S + 2HNO 3 = 2NO + H 2 SO 4.
- reakcijas disproporcija
Syrka tiek veidota līdz nesamērīgām reakcijām, ja tiek konstatēta mijiedarbība ar pļavu, sulfīdi un sulfāti:
3S + 6KOH = K 2 S + 4 O 3 + 2K 2 S -2 + 3H 2 O.
- Vietējās rūdas
- Sildot bez piekļuves pārtikai
FeS 2 = FeS + S.
- Oksidēts ūdens bez skābuma
2H 2 S + O 2 = 2 S + 2 H 2 O.
- No gāzes nonāk metalurģijas un koksa krāsnīs, karsējot katalizatora klātbūtnē
H 2 S + SO 2 = 2H 2 O + 3S.
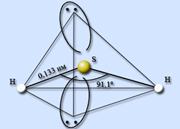
Vodneve z'adn ennya sirki - sirwater H 2 S. ... Sirevodna ir kovalenta z'єdn ennya. Molekulas ir līdzīgas ūdens molekulu molekulām, ūdens atoms atrodas sp 3 hibridizācijas stadijā, bet ūdens molekulas nepieņem nekādus uz ūdens bāzes veidotus savienojumus. Atom sirki mensh elektronegatīvs, nіzh atoms sisnyu, maє lielāks izmērsі, kā mantojums, es samazinu maksas jaudu. HSH valences griezums kļūst par 91,1 °, un H - S josla kļūst par 0,133 nm.
Sirevodns ir liecinieks un vide. Kategorija un īpašās iezīmes kategorijā "Sirvoden" 2014 rock, 2015.
Šā komponenta bilances krājumi tiek uzglabāti reģionā gāzes, gāzes kondensāta, gāzes un eļļas ģints robežās, piemēram:-gāzes rezervju attīstība noliktavā nedrīkst būt mazāka par 10 miljardiem m3; - cich komponentu krājumi procentuālā attiecībā nekļūst ...
Otruunnya nav pieejams ridin Vzhivannya pomilkovo abo namisno in nadії, scho etylovy (kharchovoy) alkohols vai ūdens, nav iespējams ražot rіdin, lai apceptu organismu. Šādas atslāņošanās pazīmes: slunker, slinks, ...
Mazs. 2.4. Viparnik att. 2.3. Desorberis att. 2.2. Absorbētājs Att. 2.5. Siltummainis "caurule caurulē" Zemas temperatūras atdalīšanas metode tiek plaši izmantota: gāzes sausināšanai; Kondensāta vizualizācija no gāzes kondensāta ģints gāzes ...
GASU Līdz noplukušam transportam. KOKS TĪRĪŠANAI UN SAGATAVOŠANAI 1. NODAĻA Att. 2. Galvenā cauruļvada izolācija Dabasgāze, kur tā plūst no virsotnēm, lai atriebtu cietās daļiņas (smiltis, mērogs), kondensāts ...
Jautras autoritātes Fiziskā jauda Ar ekstravagantu prātu sirvodden ir gāze bez gāzēm ar spēcīgu raksturīgu sapuvušu olu smaržu. Tm = -86 ° С, bp = -60 ° С, tas ir sapuvis pie ūdens, 20 ° С temperatūrā 100 g ūdens tiek izvadīts 2,58 ml H2S. Douzhe otruyniy, ar ieelpotu wiklikє ...
Sirvodnyu molekula Sirvodn ir bezbariska gāze ar sapuvušu olu smaržu. Ir labi strādāt ūdenī (20 ° C temperatūrā 1 tilpumā ūdens, tas ir 2,5 tilpuma ūdens). Ūdeni var noraidīt bez viduvējības ūdens ar ūdeni, kad tas tiek uzkarsēts, lai gan sauc par yogo ...
Jautras autoritātes
Fiziskā jauda
Ar ekstravagantu prātu sirvodden ir gāze bez gāzēm ar spēcīgu raksturīgu sapuvušu olu smaržu. T pl = -86 ° C, Tķīpa = -60 ° C, sapuvusi ūdenī, 20 ° C temperatūrā 100 g ūdens izšķīst 2,58 ml H 2 S. letāls rezultāts... Dabā var redzēt vulkānisko gāzu noliktavās, apmesties augošo un dzīvo organismu pļavā. Labs šķīdums ūdenī, izsniedzot, es salabos vāju sālsskābi.
- V ūdens šķīdumsūdens ir vāji divbāziskā skābe:
H2S = HS - + H +;
HS - = S 2 + H +.
- Siri ūdens dedzināt Povitri blakinnym pusstundas. Izmantojot savstarpēji savienotu piekļuvi, tiek izveidots derīgs sertifikāts:
2H 2 S + O 2 = 2 H 2 O + 2S.
Ar lielu piekļuvi krāsns kamīnam, ūdens jāražo pirms eļļas oksīda (IV) apstiprināšanas:
2H 2 S + 3O 2 = 2H 2 O + 2SO 2.
- Sirkhovena spēj nodrošināt jaudu. Ūdens nogulsnes var oksidēt ūdenī līdz pelēkai, tīrai gāzei un skābai skābei.
Piemēram, broma ūdens in vitro:
H 2 S + Br 2 = 2HBr + S.
apmaiņa ar hlora ūdeni:
H 2 S + 4Cl 2 + 4H 2 = H 2 SO 4 + 8HCl.
Var izšaut ūdens straumi, viktorīnu un svina oksīdu, jo superūdens reakcija var izraisīt lielu siltuma veidu:
3PbO 2 + 4H 2 S = 3PbS + SO 2 + 4H 2 O.
- Vzaєmodia sіrvodnyu ar sіrchistiy gāzi vikoristovuyutsya sirki noņemšanai no gāzēm, lai iekļūtu metalurģijas un sirhānskābes virobniztva:
SO 2 + 2H 2 S = 3S + 2H 2 O.
Cim procesa laikā vietējās sirkas apgaismojums vulkānisko procesu laikā ir saistīts.
- Ar vienas stundas tīras gāzes un ūdens plūsmu caur pļavu tiosulfāts tiek iestatīts:
4SO 2 + 2H 2 S + 6NaOH = 3Na 2 S 2 O 3 + 5H 2 O.
- Atšķaidītas sālsskābes reakcija ar zaliz (II) sulfīdu
FeS + 2HCl = FeCl 2 + H 2 S
- Alumīnija sulfīda savienošana ar aukstu ūdeni
Al 2 S 3 + 6H 2 O = 2Al (OH) 3 + 3H 2 S
- Tieša elementu sintēze kas redzams, kad ūdens izkusis sezonas laikā:
H 2 + S = H 2 S.
- Sildot parafīna summu ar sirkoy.
1.9. Ūdeņražskābe un sāļi
sālsskābe piesaistot visu vāju skābju spēku. Vona reaģē ar metāliem, metāla oksīdiem, pārtikas produktiem.
Jak ir divvērtīgs, skābe veidos divu veidu sāļus - sulfīds un hidrosulfīds ... Hidrosulfīdi ir piemēroti ūdenim, lietus un zemes metālu sulfīdi, kā arī svarīgu metālu sulfīdi ir praktiski nesagraujoši.
Melno un melno metālu sulfīdi nav saliekami, sulfīdu var raksturot ar rievām, piemēram, medi (II) sulfīdu, niķeli un svinu - melno, kadmiju, Indiju, alvu - zhovt, surmi - oranžu.
Metāla jonu sulfīdiem M 2 S var būt fluorīta tipa struktūra, izplūdes dermas atoms ir 8 metāla atomu kubs, un metāla dermas atoms ir četru atomu syr tetraedrs. MS tipa sulfīds ir raksturīgs slinkzemju metāliem, un tam var būt tāda struktūra kā nātrija hlorīds, ādas metāla atoms un citi ar oktaedru no pirmās pakāpes atoma. Ar spēcīgāku kovalento raksturu metāla-syr saite tiek realizēta struktūrās ar zemākiem koordinācijas skaitļiem.
Resnās zarnas metālu sulfīdi dabā tiek ražoti kā minerāli un rūdas, kalpo kā sīrups metālu noņemšanai.







