Fluors ir atkarīgs no oksidētāja jaudas. spēka oksidēšana
VĒRTĪBA
fluors- elements, ko var attiecināt uz halogēnu grupu. Rotācija citā VII grupas pidgrupas periodā. Apzīmējums - F.
Fluors ir nemetāls. Naybilsh elektronegatīvs elements. Ļaunajos prātos fluors ir ziedošas krāsas gāze. Otrijnijs.
Nelielā koncentrācijā fluora smaka ir nagad, ozona un hlora smarža ir viena stunda.
Fluora diatomiskā molekula F 2. Volodijai ir zemākā polarizējamība no vidējiem halogēniem. Fluora kušanas temperatūra ir neparasti zema. Tas nedarbojas labi ar ūdeni, tāpēc tas ir uzglabāšana (2F 2 + 2H 2 O = 4HF + O 2).
Fluora oksidācijas posms
Fluors pārvērš diatomiskās molekulas F 2 noliktavā, lai izraisītu kovalentus nepolārus savienojumus, un, kā šķiet, telpās ar nepolārām saitēm no ceļa oksidēto elementu pakāpieniem nulle.
raksturo fluors lielākās vērtības elektronegativitāte, savos datos vienmēr ir negatīvi oksidētā ceļa (-1) soļi (HF -1, OF -1 2, NaF -1 utt.).
Uzstādiet uzdevumus
1. PIELIKUMS
| zavdannya | Nitrīdā slāpeklis parāda oksidācijas soļus -3. Lai uzglabātu nitrīda litija, nitrīda stieņa un nitrīda silīcija formulas. |
| Lēmums | Šķietami, oksidācijas soļu litijs (+1). Lai saliktu formulu, pierakstiet vērtību ķīmiskie elementi un arī oksidācijas posms: Pēc līdzīgas noliktavas pakāpes viņi formulēja nitrīda stieni un silīcija nitrīdu. Smarža būs aizskarošā vigljada māte: Ba 2 N 3 і Si 3 N 4. |
| vidpovid | Li 3 N, Ba 2 N 3 un Si 3 N 4. |
2. PIELIKUMS
| zavdannya | Oglekļa karbīdiem ir oksidācijas soļi -4. Saglabājiet kalcija un alumīnija karbīda formulas. |
| Lēmums | Šķiet, ka kalcijs un alumīnijs acīmredzot ir oksidēti posmi (+2) un (+3). Šiem ķīmiskajiem elementiem ir raksturīgs oksidācijas soļu skaits. Lai izmantotu formulu, var pierakstīt atbilstošos ķīmiskos elementus un arī oksidācijas posmus: Mēs zinām vismazāk vietas (zīme "-" vai "+" nav vrahovuєmo): Rozdіlimo noņem vērtību no oksidācijas pakāpes vērtības, un skaitļus var pierakstīt indeksu veidā, lai molekulas noliktavai tiktu pievienoti vairāki ādas elementa atomi: |
| vidpovid | CaC 2 un Al 4 C 3. |
Oksidatorus vadošās reakcijas (OVR)- vairākas ķīmiskas reakcijas, kurās notiek elektronu pārnešana no dažām daļiņām (atomiem, molekulām, joniem) uz citām, kā rezultātā mainās oksidēto atomu soļi, kas nonāk daļiņu daļiņu krātuvē .
Atomu izskats, kuros reakcijas gaitā mainās oksidācijas soļi, ir raksturīga OVR pazīme.
perebig ķīmiskās reakcijas kopumā to pārlej, apmainoties ar daļām un reaģējot ar vārdiem. Bieži vien uzraugu apmaiņu veic elektronu pāreja no viena gabala uz otru. Tātad, ar cinka vitamīniem barotnē, vidēja (II) sulfāta veidā
Zn (t) + CuSO4 (p) = ZnSO4 (p) + Cu (t)
elektroni no cinka atomiem, lai tie nonāktu pie joniem:
Zn (t) = Zn 2+ (p) + 2 e,
Cu 2+ (p) + 2 e= Cu (t),
Iepriekš: Zn (t) + Cu 2+ (p) = Zn 2+ (p) + Cu (t).
Elektronikas izmantošanas procesu bieži sauc oksidēts un elektronisko ierīču izmantošanas process - atjauninājumus... Oksidēšana un atjaunošana tiek veikta uzreiz, tā ka saistībā ar elektronu pāreju no dažām daļiņām uz tām oksidatīvās reakcijas.
Redzamības labad aprakstīšu oksidatīvi svarīgas reakcijas. oksidācijas stadija (n)- formāls lādiņš, ko var attiecināt uz atomu, kurš var iekļūt jebkuras daļas (molekulas, jona) noliktavā, ja runa ir par konkrētās daļiņas saites tīri jonu raksturu (daļa sastāv no jonizētas atomi). Slīdot atmiņā, n vērtība rotē nevis piekariņos, bet gan pieejamo (pieņemto) elektronisko ierīču skaitā. Vienas elektroniskās ierīces lādiņš ir -1,60218 · 10 -19 Cl.
Pārāk daudz oksidēšanās-reducēšanās reakciju uzrauga, mainot oksidēto elementu soļus, lai piedalītos runas reakcijā . Atjaunojot oksidētā elementa soļus, mainās, oksidējoties - mainās . Rechovina, pirms noliktavas, kurā ietilpst elements, kas pazemina oksidācijas soļus, es saucu oksidēt, Rechovina, pirms noliktavas, kurā ietilpst elements, kas kustina oksidācijas soļus, es saucu vaininieks.
Oksidācijas posms Elementa norādītā forma sākas saskaņā ar šādiem noteikumiem:
1. oksidētā elementa pakāpe vienkāršā runā ir nulle;
2. visu molekulu atomu oksidēšanās posmu algebriskā summa līdz nullei;
3. salocītā jonā visu oksidēto atomu posmu algebriskā summa, kā arī oksidētā elementa soļi vienkāršā monoatomu jonu priekšlādē;
4. negatīvie oksidācijas soļi parādās elementa atoma fonā, kas ir mazāk elektriski negatīvs;
5. maksimālais iespējamais (pozitīvais) elementa oksidācijas solis atbilst grupas numuram, kurā elements tiek noņemts D.I. periodiskajā tabulā. Mendeļeva.
6. Viena un kovalenti polāra savienojuma gadījumā ir vairāk elektriski negatīvu atomu vairāk zemas oksidācijas pakāpju veidā.
7. Bināros failos nemetāla atomi parasti parāda minimālos oksidācijas soļus
8. Peļķes no metāla (+1), metāla galvas grupa II grupa (+2)
9. Kad ir izcelts oksidācijas līmenis, izmaiņas tiek parādītas kā elements, kas tiek parādīts tabulā. Piemēram, CaO 2: n (Ca) = +2, n (O) = - 1
10. oksidētās paskābināšanās soļi pusceļos -2, peroksīda (-1) un skābā fluora vinjetei 2 (+2).
11. ūdens parāda oksidēšanās soļus +1 visās sistēmās, izņemot metālu hidrīdus (NaH, CaH 2 uc), de oksidēto ceļu soļi -1;
Fonā parādās vairāki elementi oksidācijas posmu beigās, bet tas ir ļauns elementu oksidēšanās posmu klātbūtnē:
1) fluors, kas atrodams elektronegatīvo elementu vidū, visos oksidācijas līmeņos -1;
2) ūdens oksidācijas stadiju akās +1, izņemot metālu hidrīdus (-1);
3) iemeta IA p_dgruppi visos oksidēšanās laikos +1; 4) metāla IIA pergrupai, kā arī cinkam un kadmijam visos gadījumos var būt oksidācijas soļi +2;
4) oksidēšanās soļi ar alumīniju +3 diapazonā;
5) skābuma oksidēšanas soļi pusceļos -2, aiz vinjetes, kāda veida skābekļa piegādē molekulāro jonu klātbūtnē: О 2 +, О 2 -, О 2 2 -, О 3 -, kā arī kā fluorīdi O x F 2.
Elementu atomu oksidēšanās posmi konkrētajā vietā jāraksta virs šī elementa simbola, ieskaitot oksidācijas stadijas zīmi, un pēc tam vērtību skaits, piemēram, 4, pamatojoties uz lādiņu jonu, kas ir pierakstīt zīmi labajā pusē, un pēc tam 2+, SO 4 2-.
Citu elementu atomu oksidatīvi nozīmīgais spēks izpaužas dažādu faktoru klātbūtnē, no kuriem vissvarīgākais - Budas elektroniskais elements, oksidācijas soļi runā, pārējo reakcijas dalībnieku spēka raksturs . Z'udnannya, kuras noliktavā var nonākt elementu atomi maksimālajā (pozitīvajā) oksidācijas stadijā, piemēram, KO 4, K 2 2 O 7, HO 3, O 2, var parādīties tikai oksidēšanās. Spolu, ir iespējams uzņemt elementus zemākajā oksidācijas līmenī, piemēram, H 3, H 2, H, var tikai oksidēties un parādīties svarīgāko kvalitātē. Ieraksti, scho atriebības elementi oksidācijas starpposmos, piemēram, H O 2, H 2 ,,, Cl 3, O 2, var oksidatīvam raksturīga apakšnodaļa... Neatkarīgi no partnera, reaģējot uz šādām ēkas runām un pieņemot un sniedzot elektroniku. Atjaunošanas un oksidēto produktu noliktavu var uzglabāt arī dažādos faktoros, tostarp vidējā stadijā, ķīmiskās reakcijas veidā, reaģentu koncentrācijā, partnera aktivitātē oksidācijas procesā. Tas ir nepieciešams, lai muižniecība mainītu elementu oksidācijas līmeni, un abos gadījumos, lai mainītu oksidācijas pakāpi, tas ir vajadzīgs muižniecībai.
Naivazhivіshі oksidējošs. Ieviestie halogēni uzpūš oksidēšanās -1 posmus, līdz ar to fluora forma pārvēršas par jodu, oksidējošā jauda ir vāja (F 2 var ieskaut ar augstu agresivitāti):
2H 2 O + 2F 2 = O 2 + 4HF
mussen O 2, turklāt oksidācijas pietūkuma soļi -2:
4Fe (OH) 2 + O2 + 2H 2 = 4 Fe (OH) 3
Slāpekļskābe HNO 3 piemīt oksidatīvā spēja slāpekļa izdalīšanai oksidācijas stadijā +5:
3Cu + 8HNO 3 (atšķaidīts) = 3Cu (NO 3) 2 + 2NO + 4H 2O
Ikreiz, kad tiek apstiprināts plašs jaunu produktu klāsts:
NĒ 3 - + 2H + + e= NO 2 + H 2 O
NĒ 3 - + 4H + + 3 e= NĒ + 2H 2 O
NĒ 3 - + 5H + + 4 e= 0,5 N 2 O + 2,5 H 2 O
NĒ 3 - + 6H + + 5 e= 0,5N 2 + 3H 2O
NO 3 - + 10H + +8 e= NH 4 + + 3H 2 O
Slāpekļa glikīns tiek nogulsnēts kā skābes koncentrācija, kā arī svina aktivitāte:
skābes koncentrācija
¾¾¾¾¾¾¾¾¾¾¾¾¾
NO 2 NO N 2 O N 2 NH 4 +
¾¾¾¾¾¾¾¾¾¾¾¾¾®
galvenā pētnieka darbība
Sāls slāpekļskābe ( nitrāti) Var izmantot skābos metālos un kopā ar aktīvajiem metāliem, peļķēs, kā arī kausējumos:
Zn + KNO 3 + 2KOH K 2 ZnO 2 + KNO 2 + H 2 O
Čarska Gorilka- koncentrētas slāpekļskābes un sālsskābes summa, tilpuma attiecības samazināšanās 1: 3. Tsієї sumіshі nosaukums ir saistīts ar laiku, tāpēc jūs neatradīsit tādus cēlmetālus kā zelts un platīns:
Au + HNO 3 (conc) + 4HCl (conc) = H + NO + 2H 2 O
Sirchana skābe H 2 SO 4 oksidētā jauda koncentrētā šķīdumā ūdens graudam oksidācijas stadijā +6:
C (grafīts) + 2H 2 SO 4 (konc.) CO2 + 2SO 2 + 2H 2 O.
Atjaunošanai paredzēto produktu noliktava ir galvenā skābes atjaunošanas un koncentrācijas darbība:
SO 4 2- + 4H + + 2 e= SO 2 + 2H 2 O
SO 4 2- + 8H + + 4 e= S + 4H 2O
SO 4 2- + 10H + + 8 e= H 2 S + 4 H 2 O
skābes koncentrācija
¾¾¾¾¾¾¾¾¾¾¾¾¾
¾¾¾¾¾¾¾¾¾¾¾¾¾
galvenā pētnieka darbība
Šie sāļi bieži ir ļauni kā oksidējoši, ja tiem ir divkāršs raksturs. Parasti cich spoluk atjaunošanas produkti ir hlorīdi un bromīdi, kā arī jods:
MnS + 4HClO = MnSO4 + 4HCl;
5Na 2 SO 3 + 2HIO 3 = 5Na 2 SO 4 + I 2 + H 2 O
kalija permanganāts KMnO 4 oksidējas mangānam oksidācijas stadijā +7. Nepatiesi no vidus, pretējā reakcijas veidā, tas tiek ievadīts jaunajos produktos: skābā vidū - mangāna (II) sāļos, neitrālā - mangāna (IV) oksīdā manganāta formā MnO ( - OH) 2, sulīgajā jonā MnO 4 2-:
skābs vidusceļš:
5Na 2 SO 3 + 2 KMnO 4 + 3H 2 SO 4 (atšķaidīts) = 5 Na 2 SO 4 + 2 MnSO 4 + 3H 2 O + K 2 SO 4
neitrāls vidus:
3Na2SO3 + 2KMnO4 + 3H2O = 3Na2SO4 + 2MnO (OH) 2¯ + 2KOH
peļķes vidusceļš:
Na 2 SO 3 + 2 KMnO 4 + 2 KOH = Na 2 SO 4 + 2K 2 MnO 4 + H 2 O
kalija dihromāts K 2 Cr 2 O 7, pirms molekulas uzglabāšanas hroms nonāk oksidācijas stadijā +6, є paskābināšanās gadījumā stipri oksidējas:
6KI + K 2 Cr 2 O 7 + 7H 2 SO 4 (s) = 3I 2 + Cr 2 (SO 4) 3 + 7H 2 O + 4K 2 SO 4
neitrālā centrā:
3H 2 S + K 2 Cr 2 O 7 + H 2 = 3S¯ + 2Cr (OH) 3 ¯ + 2KOH.
Oksidācijas spēka vidū oksidāciju papildina H + un metāla klātbūtne oksidācijas reģionā. jonu vodnju H + vistupajaks, kas oksidējas aktīvo metālu mijiedarbībā ar skābju atšķaidīšanu (vainojams HNO 3): Mg + H 2 SO 4 (atšķaidīšana) = MgSO 4 + H 2
Jonu metāls salīdzinoši augstā oksidācijas līmenī, piemēram, Fe 3+, Cu 2+, Hg 2+, kas tiek ieviesti, tiek pārveidoti par augstāku zemu oksidācijas līmeni:
H 2 S + 2 FeCl 3 = S¯ + 2 FeCl 2 + 2HCl
Tas ir redzams no sāļu atšķirībām metālos:
2Al + 3CuCl 2 = 2AlCl 3 + 3Cu.
Newswires. Pirms tipiskajiem vidus vienkārša runa aktīvie metāli, piemēram, peļķe un peļķes zemes metāli, cinks, alumīnijs, zelts un in., kā arī nemetāli (ūdens, ogleklis, fosfors, silīcijs): Zn + 2HCl = ZnCl 2 + H 2
C + 4HNO 3 (konc., Gir) = CO 2 + 4NO 2 + 2H 2 O
Ūdens galvenās funkcijas ir anjoni bez skābēm, piemēram, Cl-, Br-, I-, S2-, H-, un metāla katjoni oksidācijas apakšējā stadijā:
2HBr (konc) + H202 (konc) = Br2 + 2H20;
2CaH 2 + TiO 2 2CaO + Ti + 2H 2.
2FeSO 4 + H 2 O 2 (konc.) + H 2 SO 4 (atšķaidīts) Fe 2 (SO 4) 3 + 2H 2 O.
Oksidatīvi zināms dubults. Vienkārši sakot, oksidatīvi pazīstamais dubults ir raksturīgs VIIA, VIA un VA grupas elementiem, kas var gan palielināt, gan samazināt to oksidācijas stadijas.
Bieži uzvar kā oksidētājs, halogēns no otras puses, spēcīgākiem oksidētājiem tie šķiet spēcīgāki (vainojams fluors). Oksidētā celtniecības jauda mainīsies, un ēkas tilpums palielināsies no Cl 2 līdz I 2. Joda gaismas reakcijas īpatnība, ko oksidē hlors ūdens šķīdumā: I 2 + 5Cl 2 + 6H 2 O = 2HIO 3 + 10HCl .
Skābes un halogēniі їх sāls Pirms molekulu, kas satur halogēnu, uzglabāšanas oksidācijas rūpnieciskajā stadijā, var būt ne tikai oksidēšanās:
S + NaClO 2 NaCl + SO 2
ale і vіdnovnikіv:
5NaClO 2 + 2KMnO 4 + 3H 2SO 4 (atšķaidīts) = 5NaClO 3 + 2MnSO 4 + 3H 2 O + K 2 SO 4
Peroksīds Lai atriebtu skūpstu oksidācijas solī -1, tipisku reducētāju klātbūtnē ir oksidācijas spēks, tāpēc skūpsts var samazināt tā oksidācijas soļus līdz -2:
2KI + H 2 O 2 = I 2 + 2KOH
un mijiedarbības gadījumā ar spēcīgiem oksidētājiem izpaužas varoņa spēks (oksidētās skābes augšanas soļi līdz 0):
H 2 O 2 + 2Hg (NO 3) 2 = O 2 + Hg 2 (NO 3) 2 + 2HNO 3.
slāpekļskābeі nitrīti, Pirms noliktavas, kurā ir slāpeklis oksidācijas stadijās +3, to var izmantot arī kā oksidētājus: 2HI + 2HNO 2 = I 2 + 2NO + 2H 2O,
tātad un atsauces lomā: 2NaNO 2 (dil, gir) + O 2 = 2NaNO 3.
Vidējā posma skābuma infūzija, ņemot vērā reakcijas produktus, ir īpaši labi īstenota uz Permanganāta jonu MnO 4 atjaunošanas dibena.
a) skābā vidē, Saskaņā ar pirmo shēmu, pret labāko iespējamo mangāna atoma atjaunošanos.
MnO 4 - + 8H + + 5e - → Mn 2+ + 4 H 2 O.
Tajā pašā laikā tiek izveidoti mangāna (II) sāļi, kuru anjoni atrodas skābē, bet vidus ir skābs. Tātad, skābā vidē veidojas MnSO 4, sāls slānī MnCl 2. Zīmīgi, ka metāla mangānu nevar pieņemt, jo metāls rindā, pārējie metāli biežāk ir ūdeņaināki un oksidē jonamіH +. b) neitrālā stāvoklī(Vāji auksts vai nedaudz skābs vidus) permanganāta jonu ievada mangāna dioksīdā MnO 2 , Scho vipadaє z līnija melnbrūnā viglyadі aplenkumā
MnO 4 - + 2Н 2 О + 3е - → MnO 2 + 4ОН -.
Kopumā bieži notiek rozes aizķeršanās.
v) ļoti dubļainā vidū Elektronu pārnešana radīs lielas grūtības (ar lielu negatīvi lādētu jonu koncentrāciju ON -). Zaļāka manganāta jonu MnO 4 2- atjaunošana:
MnO 4 - + 1е - → MnO 4 2-
Dziedot cieņu par nepieciešamību parādīt, kad roboti ar hroma (VI) pusēm. Labajā pusē, ļoti skābajā vidējā dihromāta jonā Cr 2 O 7 2-, peļķes vidū ir spēcīga oksidētāja spēja, bez izmaiņām oksidācijas stadijā, Tas pārvēršas par hromāta jonuCrO 4 2-, kas ir vēl vājāks oksidētājs.
Cr 2 O 7 2- + 2ОН - → 2CrO 4 2 + Н 2 О
Navpaki, hromāts skābā vidē Dichromate.
2CrO 4 2 + 2Н + → Cr 2 O 7 2- + Н 2 О
Skābā vidē Cr 2 O 7 2- jonu veido līdz joniem Cr 3+:
Cr 2 O 7 2- + 14H + + 6e - → 2Cr 3+ +7 H2O
Atkarībā no konkrētā prototipa un reālajiem skābes bāzes parametriem, hroma diapazonu var novērot vai nu pirms Cr (OH) 3 aplenkšanas, vai arī, ņemot vērā hroma (III) amfoteriskās spējas, līdz kritiskajam kompleksam anions 3. Jebkuros produktos būs pieejams hroma atjauninājums + III.
No otras puses, ja peļķes centrā tiek veikta oksidēšana ar hromu, tad oksidētie produkti būs hromāts CrO 4 2-, ja skābā vidē tiek pievienots oksidēts, tad oksidētie produkti būs Cr 2 O 7 2 -.
Koncentrācijas ievadīšana reakcijas produktu noliktavā
Reaktīvo šķidrumu koncentrācijas ievadīšana OVR, visticamāk, izpaužas reakciju pielietošanā ar slāpekļskābi un sālsskābi.
Slāpekļskābes reakcijas.
Nagadaєmo, tsі acid un uzreiz і і oksidējoši, і vidū radītāji.
Slāpekļskābe reaģē, jaks oksidējas, ar metāliem, oksīdiem un metālu hidroksīdiem oksidācijas starpposmos, ar nemetāliem un іх oksīdiem, tā ka nemetāls tiek aizstāts oksidācijas starpposmā. Slāpekļskābes atjaunošanās produkti parasti veido rehovīna summu (kas parasti ir oksidēta), lai gan koncentrācijas klātbūtnē viens un tas pats produkts tiks sajaukts reakcijas summā. Eksperimentālā ceļā bulo noteica likumu sākumu:
Pievieno koncentrētu slāpekļskābi NĒ 2 .
NO 3 - + 2H + + 1e - → NO 2 + H 2 O
Slāpekļskābi atšķaida pēc tilpuma un pievieno NĒ.
NO 3 - + 4H + + 3e - → NO + 2H 2 O
Slāpekļskābi tālāk atšķaida, reaģējot ar aktīvo prekursoru (Mg, Ca, Ali utt.), Pievieno amonija sāli - nitrātu NH 4 NĒ 3 .
NO 3 - + 10H + + 8e - → NH 4 + + 3H 2 O
Atjaunojamo produktu noliktavā var būt arī gāzveida slāpeklis N 2, N 2 O.
1. Fluora atmosfērā šādi stijki vārdi deg,
jaku sklo (pie viglyadі vati), ūdens. Viens no raktuves produktiem ir skūpsts, t.i., fluora jaks skābāk oksidējas:
SiO2 + 2F2 → SiF4 + O2;
2H2O + 2F2 → 4HF + O2.
2. Aktīvi apmainiet fluoru ar vienkāršākiem vārdiem. Ar syroї un fosforu iegūstiet modalitāti reti krēslas temperatūrā (-190 ° C):
S + 3F2 → SF6;
2P + 5F2 → 2PF5.
Fluors oksidējas līdz navit deyaki iekšējām gāzēm (ksenons),
ale nav kopā ar želeju, neonu un argonu:
Xe + 2F2 → XeF4.
Visaktīvākais nemetāls, kas satricinoši savijas ar atskaņu, gaismas, fluorīdu izmantošanu augstākajos oksidācijas posmos un sarkanīgajām vinjātām - fluoroplastiku, un no vairākām no tām - no raktuvēm. Līdz fluoram istabas temperatūrā tika veikti pasākumi fluora pagatavošanai, galma reakcija ar fluoru - Al, Mg, Cu, Ni.
Novietojiet fluoru saskarē ar ūdeni, līdz tas uzsūcas, un vējiet to ar loku zemas temperatūras(Līdz -252 ° C ). Fluora atmosfērā, lai sadedzinātu ūdeni un platīnu:
2F2 + 2H2O → 4HF + O2
Pirms reakcijām, kurās formāli galvenais varonis ir fluors, notiek citu fluorīdu izplatīšanās reakcijas, piemēram:
2CoF3 → 2CoF2 + F2
MnF4 → MnF3 + 1/2 F2
Fluoru var arī oksidēt elektrības kontaktligzdā, skābekli saturošā fluorīdā OF2 un deoksidifluorīdā O2F2.
Visos gadījumos fluors uzrāda oksidācijas soļus -1
Tālumā esošajiem ķīmiķiem atņemiet difluorīdu, lai viņi varētu izlikties ar fluoru uz vājas pļavas:
2F2 + 2NaОН = 2NаF + OF2 + H2O.
Slāpekļa fluoru nevar atstāt, bet 1928. gadā slāpekļa trifluorīdu NF3 netiešā ceļā no Otto Ruffo fluora atdalīja. Vіdomі un inhi slāpekļa savienojumi ar fluoru. Kad piekļūsit ēdienam, tas iedegsies. Vugilla spalakhu ciems fluora atmosfērā augstā temperatūrā.
Zelts aukstumā vēl vairāk sajaucas ar fluoru, un, cepts, tas sadedzina jaunu. Platīns ar neparastu prātu nereaģē ar fluoru, ale sadedzina jaunu, karsējot līdz 500–600 ° C.
Ar boru, silīciju, fosforu, mish'yak Fluoru izmanto aukstos apstākļos, kā arī veido fluoru.
Kad fluors aukstumā mijiedarbojas ar metāla oksīdiem, tiek noteikts metāla fluors un skūpsts; Ir iespējams apstiprināt arī metāla oksifluorīdu (piemēram, MoO2F2). Nemetālu oksīdi vai fluora ievadīšana, piemēram, SO2 + F2 = SO2F2, vai skābeklis tajos tiek aizstāts ar fluoru, piemēram, SiO2 + 2F2 = SiF4 + O2. Sklo biežāk reaģē ar fluoru ;. Slāpekļa oksīds NO un NO2 ir viegli iekļūstami fluorā, izmantojot nitrozilfluorīda FNO un nitrīta fluorīda FNO2 preparātu. Oglekļa oksīds (II), ko silda ar karbonilfluorīda šķīdumiem, ienesa fluoru: CO + F2 = COF2.
Metāla hidroksīdu var reaģēt ar fluoru, ļaujot izšķīdināt metāla fluorīdu un skābekli, piemēram, 2Ва (ОН) 2 + 2F2 = 2BaF2 + 2Н2О + О2. ūdens šķīdumi NaOH un KOH reaģē ar fluoru 0 ° С temperatūrā saskaņā ar OF2.
Metāla halogenīdi vai nemetāli aukstumā mainās ar fluoru, un fluors aizstāj visus halogēnus.
Viegli fluorējošs sulfīds, nitrīds un karbīds. Metālu hidrīdi ar fluoru aukstā metāla fluorīdā un HF; amiak (pa pāriem) - N2 і HF. Fluoru aizstāj ar ūdeni skābēs vai metālos їх sāļos, piemēram, HNO3 (vai NaNO3) + F2 = FNO3 + HF (vai NaF); grūtākos prātos fluors ir vitisnyaє kissen no cich spoluk, ko var izmantot sulfurilfluorīdam, piemēram, Na2SO4 + 2F2 = 2NaF + SO2F2 + O2. Karbonāts un nemetāla metāli ekstremālās temperatūrās reaģē ar fluoru; Tajā pašā laikā ir fluora, CO2 un O2 maisījums.
Fluors enerģiski reaģē ar organisku runu.
izskalojiet fluoru pie vilny stanі elektrolizom
thi-izkusis spoluks (HF izkausētā kalcija dihidrofluorīdā KH2F3).
Dzherel attiecībā uz virobniztva Fluors ir fluorūdens, kas galvenokārt nonāk vai nu ar sālsskābes klātbūtni H2SO4 · fluorītam CaF2, vai arī apstrādājot apatītu un fosforītu .. citu fluorīdu izplatīšanai.
2CeF4 = 2CeF3 + F2
Koncentrējot ar ūdeni, fluors kādu dienu būs gāzveida - ūdeņraža fluorīds HF... Ūdeņraža fluorīda ūdens šķīdumus sauc par fluorūdeņražskābi. Gāzei līdzīga HF ir bezsvara gāze ar asu smaku, vēl krasāk uz disfunkcionāliem organismiem un gļotādām.
noraidotĻoti īpašs veids, kā to noraidīt, ir sālsskābes izmantošana fluorspāram CaF2:
CaF2 + H2SO4 = CaSO4 + 2HF.
Fluora vibrācijas mijiedarbība ar ūdeni zemā temperatūrā un (hlora rezultātā) temperatūrā ar ūdeņraža fluorīda šķīdumiem:
H2 + F2 → 2HF.
Ūdeņraža fluorīda molekula ir stipri polāra, μ = 0,64 · 10-29 Cl Ūdens savienojumu enerģija FH FH kļūst aptuveni 42 kJ / mol, un vidējās polimerizācijas stadijas gāzes fāzē (viršanas temperatūrā) ≈4. Navit gāzveida dzirnavās, fluorūdeņradis tiek uzglabāts no polimēru summas H2F2, H3F3, H4F4, H5F5, H6F6. HF molekulām ir viegli izdzīvot temperatūrā līdz 90 ° C. Tajā pašā laikā ūdeņraža fluorīda pazemināšanās augstā temperatūrā samazinās 3500 ° C temperatūru (vairāk kā volframa - ugunsizturīgākā metāla kušanas temperatūra) ). Putrai - ūdenī temperatūras kritums kļūs spilgtāks temperatūrā līdz 2000 ° C.
HF kristāla dzirnavās veidojas ortorombiski kristāli, kas salokās ķēdes līdzīgās struktūrās: sagriezti HFH = 116 °, d (F-H) = 95 pm, d (F H) = 155 pm. analogs zyґzaґopodibnі
lantsyuga ar samazinātu HFH = 140 °) var būt polimēra HF, gāzes fāzē.
Fluorūdeņražskābe. Jautras autoritātes dіє par visiem iemeta, aiz zelta un platīna vinjetes. Vidēji un vidēji fluorūdeņražskābe ir vēl izplatītāka. Vāji razcini її absolūti neattiecas uz alvu, varu un bronzu.
Tas ir izturīgs pret fluorūdeņražskābi un svinu, ko var pārklāt ar svina fluora bumbiņu, ko var izmantot, lai aizsargātu metālu no noteiktas drupas. Šim nolūkam svins un kalpo kā materiāls fluorūdeņražskābes ražošanas aparātam.
НF molekulu vēsums līdz asociācijai jāveic pirms fluorūdeņražskābes un skābes vidējiem sāļiem, piemēram, KHF2 (ar kuru fluors tiek noņemts ar elektrolīzi). Tajā pašā laikā atšķirība starp halogenskābes skaitu, kas dod tikai vidējos sāļus.
Fluorūdeņražskābes raksturīgā iezīme, kas iegūta no visām pārējām skābēm, ir ārkārtīgi vienkārša silīcija dioksīda SiO2 un silīcijskābes sāļiem:
SiO2 + 4НF = SiF4 + 2H2O.
Silīcija tetrafluorīds SiF4 - gāze, reakcijas laikā iztvaiko.
Dіyuchi uz silīcija dioksīda, scho, lai iekļūtu noliktavā, fluorūdeņražskābes rožu sklo, tāpēc to nav iespējams iegūt daudzos traukos.
No organiskajām plūsmām fluorūdeņražskābi izmanto papīram, kokam, korķim, ogļskābei. Uz plastmasas tas ir vājš, absolūti ne uz parafīna, kas ložņā ar fluorūdeņražskābi traukos, kas ir sadalīti no materiāla.
HF spēks apgulties ūdens klātbūtnē. Sausais fluorīda ūdens nav piemērots lielam metālu daudzumam un nereaģē ar metāla oksīdiem. Tomēr, tiklīdz reakcija sākas, ir ilgs laiks līdz autokatalīzei, tāpēc izmaiņu rezultātā ir daudz braukšanas un uzlabojumu:
MO + 2HF = MF2 + H2O
Ridky HF ir spēcīgs jonizējošs līdzeklis. Visa elektrolīze jauna, ar perhlorskābes un HClO4 vinjeti, starp citu:
HCl + 2HF ↔ ClH2 + + HF2-
Ūdeņraža fluorīda gadījumā skābā jauda izpaužas uz pusi kā jonu fluora akceptori, piemēram, BF3, SbF5:
BF3 + 2HF → FH2 + + BF4-
Amfotēriskie spieķi bagātākā ūdeņraža fluorīda є vidū, piemēram, alumīnija fluorīds un hroms (III):
3NaF + AlF3 → 3Na + + AlF6-
(AlF3 - jaku skābe)
AlF3 + 3BF3 → Al3 + + 3BF4-
(AlF3 - jaku pіdstava)
Ūdeņraža fluorīds netiek mainīts ūdenī, kad HF molekulas tiek jonizētas.
Cena ir dota galvas grupas VIII grupas elementiem - iekšējām vai cēlgāzēm, vismaz dažus nobeigumus sauc par elektronisko bumbu. Atomu un elementu elektroniskā konfigurācija ir tāda, ka nav iespējams tos novest ne pie metāliem, ne uz nemetāliem. Smaržo ar šiem priekšmetiem, tāpat kā dabiskajā sistēmā, tie skaidri sadala elementus uz metāla un nemetāla, kas aizņem vietu to tuvumā. Inertu vai cēlu gazi ("muižniecība" inercē virpuļo) dažreiz var aiznest uz nemetāliem, kaut arī tīri formāli, aiz fiziskām pazīmēm. Ir iespējams ietaupīt gāzes pārveidotāju līdz pat zemām temperatūrām.
Ķīmijas enerģija ir ievērojama šiem elementiem. Ksenonam un kriptonam tie ir daļēji fluora un skābi. Ārprātā, dienas gaismā, fonā, gāzes spēlēja līderu lomu.
Nemetālisko pēdu vērtība, ko šiem atomiem raksturo augsta elektroenerģijas vērtība. Оіа izmaiņas robežās no 2 līdz 4. Nemetāli - galvas grupu elementu mērķis, vēl vairāk elementu, vignatok kļūst par ūdeni - s -elementu.
Visi nemetāla elementi (crim vodnyu) aizņemas periodiskās sistēmasķīmijas elementi D. I. Mendeleva augšējā labajā pusē, triko, ar fluoru augšpusē.
Tomēr īpaši svarīgi bija koncentrēties uz neviennozīmīgo iestatījumu periodiskajā sistēmā: galvas grupu I un VII grupā. Tse nav vipadkovo. Vienā pusē ūdens atoms, līdzīgs svešu metālu atomiem, uz vienas (un viena jaunai) elektroniskai lodītei (viena konfigurācija 1s1) ir viena elektroniska bumba, kas ir garīgā stāvokļa vaina. varas spēks.
Daudzos no tiem ūdens, piemēram, metāla peļķes, uzrāda oksidēšanās soļus +1, savukārt atoma elektrona izvade ir svarīgāka, bet citu metālu atomiem tā ir mazāk svarīga. No otras puses, ūdens atoms, tāpat kā halogēnu atomi, lai pabeigtu pēdējo elektronisko bumbu, viena elektrona laulību, šo atomu var uztvert viens elektrons, parādot oksidētāja spēku un raksturīgo oksidēšanās halogēna stadijas, -1 hidrīdos - z'єdnan metāli ar halogēniem - halogenīdi. Ja atomā ienesīsiet vienu elektronu, tas būs svarīgāk nekā ar halogēniem.
Ar prāta prātu ūdens ir H2 - gāze. Joga molekula, līdzīga halogēniem, diatomiska.
Nemetālu atomi paļaujas uz spēka oksīdiem, tādējādi piesaistot elektrību. Elektriskā negatīvisma vērtības raksturojuma kvalitāte, kas dabiski mainās periodos un grupās (47. att.).
fluors- spēcīgākais oksidējošais atoms ķīmiskajās reakcijās nav pieejams elektrībai, tāpēc tam ir liela jauda.
Jaunās elektroniskās bumbas konfigurēšana
Іnshі nemetāli var parādīt papildu jaudu, ja viņi to vēlas ievērojami augstākā mērā attiecībā uz metāliem; Periodos un grupās ir svarīgi, lai ēka mainītos virpuļveida secībā oksidatīvā gadījumā.
Ķīmiski nemetāliski elementi kopā 161 Tročas aicinājums, kas ir vrahuvati, redzams 114 elementos. Divi nemetāliski elementi uzglabā 76% zemes masalu masas. Ceysen (49%) un silīcijs (27%). Atmosfērā ir 0,03% zemes garozas masas. Nemetāli tiek uzglabāti 98,5% no rozīna masas, 97,6% no tila cilvēku masas. Vairāki nemetāli - C, H, O, N, P un S - ir biogēni elementi, kurus var izmantot dzīvu šūnu svarīgākajai organiskajai runai: dzērieni, tauki, ogļhidrāti, nukleīnskābes. Pirms povitrya, yakim dikhaєmo noliktavas ir vienkārša un saliekama runa, kā arī elementu nostiprināšana ar nemetāliem (skābeklis, skābeklis, slāpeklis, oglekļa dioksīds CO2, ūdens tvaiki H2O un.).
ūdens diena - galvas elements Vsesvita. Bagato kosmiskie objekti (gāzes, staipekņi, zvaigznes, ieskaitot Sonce) vairāk nekā puse tiek uzglabāti ūdenī. Uz Zemes, ieskaitot atmosfēru, hidrosfēru un litosfēru, tikai 0,88%. Tas ir nedaudz pēc svara, un atomu svars ir vēl mazāks. Tā nav lieliska vieta, kur būvēt, jo uz Zemes 100 ādas atomu dēļ 17 ir atomi.
Vienkārša nemetāla runa. Budova. Fiziskā jauda
Vienkāršā runā nemetālu atomi ir piesaistīti ar kovalentu ar nepolāru gredzenu. Personāls ir veidots ar lielāku elektronisko sistēmu, zemāk pie izolētajiem atomiem. Tajā pašā laikā atsevišķas (piemēram, ūdens H2 molekulās, Ki, Br2 halogēnos), apakšlīnijas (piemēram, sirsnīgā troņa molekulās (piemēram, slāpekļa kovalento saišu molekulās).
Kā jau redzat, vienkārši vārdi, nemetāli, var kļūt par māti:
1. Molekulārā Budova. Ar ekstravagantu prātu lielākā daļa šādu runu ir gāzētas un, ja ne smagas, runas vai mazāk par vienu broma (Br2) є ridinoju. Visas molekulārā budovi runas, tik lidojošas. Cietās dzirnavās smaka ir sakausējama starpmolekulārās mijiedarbības vājuma dēļ, kas samazinās kristālu molekulas un palielinās sublimāciju.
2. atomne budova... Uzrunas apstiprināja atomu lancers. Caur lielajām kovalentiskajām smakas saitēm, kā likums, šķiet, ka tas ir ļoti grūti, un vai tās būtu čūskas, kas savītas ar kovalentajām saitēm savos kristālos (kušana, tvaiki), lieliska vitalitāte. Bagato takі rechovini mayut paaugstināta temperatūra kūst un vārās, un svārstīgums ir pat zems. (Bērnam 47 sēdekļi ir klusu nemetālisku elementu simboli, jo tie der tikai atomu kristāla režģiem.)
Bagato elementi -nemetāli rada vienkāršu vārdu piejaukumu - allotropiskas modifikācijas. Jak vi pam'yataєte, atomu spēku sauc par allotropiju. Allotropiju var saistīt ar nelielu molekulu krātuvi un augošu budisko kristālu. Oglekļa є grafīta, dimanta, karabīna, fullerēna alotropās modifikācijas (48. att.).
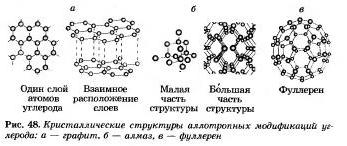
Elementi-nemetāli, kas ir allotropijas spēks, tiek piešķirti mazajai 47. zvaigznei. Tātad, ir vairāk vienkāršu nemetāla vārdu nekā vairāk, mazāk ķīmisku nemetāla elementu.
Jūs zināt, ka aiz reta vinja (zelta, vidus un dejaki) ir trīs lieli metāli, kas raksturīgi vidēja lieluma vīnam. Un vienkāršu nemetālisku vārdu ass, krāsu gamma ir nozīmīga.
Nepretenciozs ar lielu pamanāmību fiziskais spēks nemetāli, tomēr kāda iemesla dēļ tas ir nepieciešams un deyakі їkh zagalny rīsi. Visas gāzei līdzīgās runas, reti sastopamais broms, kā arī kovalento kristālu veidi - dielektriķi, kā arī visi jaunākie Viktorijas laika atomu elektroni ķīmisko skaņu radīšanai. Kristāli ir neplastiski, ja tā ir ļaunuma deformācija, kovalento saišu sagraušana. Daudziem nemetāliem nav metāliska atspīduma.
Jautras autoritātes
Tie nozīmēja arī nemetālu atomus, kā arī vienkāršos vārdus, ko viņi noskaidroja, tie bija raksturīgi gan oksidējoši, gan arī spēkam.
Nemetālu vienkāršu vārdu oksidēšana
1. Nemetālu oksidatīvais spēks izpaužas, pirmkārt, to mijiedarbības gadījumā ar metāliem (kā zināms, tie bija priekšteči, kas to iemeta):

Hlora Сl2 oksidācijas spēks ir izteiktāks, pelēkā gadījumā zemāks, un metāls ir Re, kas oksidācijas stadijās ir mazāks +2 b +3. oksidēties līdz augstākam oksidācijas līmenim.
2. Lielākajai daļai nemetālu ir mijiedarbība ar ūdeni. Tā rezultātā parādās lidojoši ūdensceļi.
3. Esiet nemetāls oksidētāja lomā reakcijās ar šiem nemetāliem, kuriem var būt zemāka elektrības vērtība:
Sēklu elektronegativitāte ir augstāka, zemāka nekā fosforam;
Fluora elektronegativitāte ir augstāka, zemāka visos citos ķīmiskajos elementos, kas ir saistīts ar faktu, ka oksidētājs ir spēcīgs.
Fluors ir spēcīgākais oksidētājs no nemetāliem, parādot reakcijās tikai oksidētāju.
4. Nemetālu oksidējošās spējas parādās reakcijās ar darbībām saliekot vārdus... Ne tikai skūpsti, ali un nemetāli, tie var būt arī oksidētāji reakcijās ar saliekamām mēlēm - neorganiskas un organiskas.
Spēcīgi oksidējošais hlors Сl2 oksidē zaliza (II) hlorīdu par zaliza (III) hlorīdu.
Jūs pam'yataєte, zychay, kā reakcija uz nevardarbīgo z'єdnanni - sacietējušo broma ūdeni.
Vіdnovnі vienkāršu runu spēks - nemetāli
Aplūkojot nemetālu reakcijas, viens no tiem nozīmēja, ka gružu klātbūtnē viens no tiem parādīja oksidētāja spēku, bet pēdējais-līdera spēku.
1. Saskaņā ar reducēšanu līdz fluoram, visiem nemetāliem (navit kisen), šķiet, ir liels spēks.
2. Zrozumіlo, nemetāli, smalks fluors, mijiedarbojoties ar kisne, kalpo kā reducētāji:

8 Bagato nemetelli var redzēt vadošo lomu reakcijās ar salokāmām flautām, kas oksidējas:
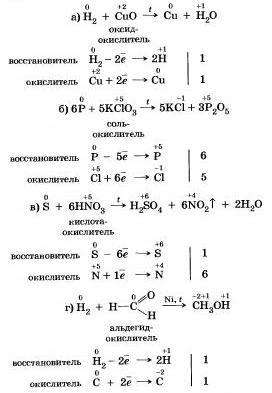
Pastāv šāda reakcija, kurā viens un tas pats nemetāls tiek nekavējoties oksidēts, vissvarīgākajā veidā, pašoksidācijas-pašatjaunošanās reakcija.
Otzhe, pidib'amo pid somas! Lielākā daļa nemetālu var parādīties ķīmiskās reakcijās gan oksidētāja, gan līdera lomā (papildus tikai fluoram).
Vodnevі spoluki nemetāli
Pateicoties visu nemetālu dedzīgajam spēkam-vasaras ūdens augu radīšanai, lielā skaitā nemetālu ir zemākas oksidācijas stadijas.
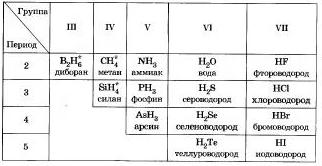
Šķiet, ka lielāko daļu vienkāršo ci var noraidīt bez sintezējama nemetāla.
Vm ūdensapgāde nemetāli ar nemainīgu polaritāti, var izraisīt molekulāro buddov un ārkārtas prātu gadījumā ar gāzēm, piemēram, ūdeni (ridina). Lla vodnevyh z'udnan nonmetals raksturo velvju satiksme uz vodi. META іnlan praktiskā nesschinnі. Amonija hidroksīds, izšķīdināts ūdenī, tiek izmantots, lai iepriekš uzstādītu plātnes - amonija hidroksīdu.
Ūdens un puse no nemetāliem oksīda bāzes reakcijās, izņemot pamanāmas autoritātes, vienmēr parāda līderu autoritāti, un pat tajos nemetāls var pazemināt oksidācijas soļus.
Nemetāla oksīdi un vispārējie hidroksīdi
Nemetāla oksīdos saites starp atomiem ir kovalentas polāras. Molekulāro oksīdu vide є gāzei līdzīga, rydki (gaistoša), cieta (gaistoša).
Nemetāla oksīdus var iedalīt divās grupās: neveido sāli un veido ledus. Sadalot skābos oksīdus, ūdenī veidojas oksīdu hidrāti - hidroksīdi, to dabai - skābes. Skābes un skābju oksīdi ķīmisku reakciju rezultātā veido sāļus, dažos nemetālos tiek veikti oksidācijas soļi.
Oksīds un tipa hidroksīdi ir skābes, dažos nemetālos tie parāda oksidācijas soļus, kas ir svarīgi grupas numuram, tāpēc tie ir svarīgi, tos sauc par pārtiku. Aplūkojot Periodisko likumu, viņi arī raksturoja savu noliktavu un spēku.
Oksīdu un shdronepdop skābās spējas stiprināšana Vienas galvas grupas robežās, piemēram, VI grupā, piemēram, sākas citu oksīdu un hidroksīdu jaudas izmaiņu regularitāte.
Ja nemetālam ir izveidoti divi vai vairāki skābi oksīdi, un tas nozīmē, ka tie ir abu veidu skābes, tad nemetāla skābums pieņems augstākus nemetāla oksidācijas līmeņus.
Oksidiem un skābēm, kurās nemetāli ir galvenie oksidācijas soļi, var būt tikai oksidācijas spēks.
Oksīds un skābe, kas nav metāls, oksidācijas starpposmos var parādīt gan oksidāciju, gan vispārējo jaudu.
praktisks darbs
1. Pirms jebkuras elektroniskās dzimtās zemes ukis elementi-nemetāli?
2. Kas ir nemetāliski elementi є biogēni?
3. Kādi faktori ir nemetāla atomu valences spējas? Apskatiet atomu un māsu pielietojumu.
4. Kāpēc daži nemetāli ar neparastu prātu - gazi, іnshі - ir grūti ugunsizturīgi vārdi? 5. Lai vadītu vienkāršu nemetālisku vārdu galus, lai tos ar lielu prātu varētu dzirdēt nelielā pildvielas dzirnaviņā: a) gāzveida, b) raupja, c) cieta.
6. Noliktava nemetālu dalībai. Kāda jauda (oksidācija vai ievads) parāda nemetālus šajās reakcijās?
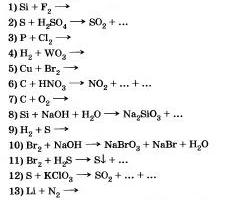
Kādi ir augstākas ūdens un sālsskābes temperatūras cēloņi, kas ir tuvāk ūdens un selēna ūdeņraža temperatūrai?
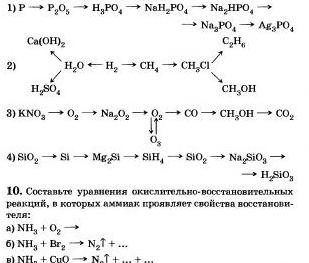
7. Kāpēc metāns no rīta ir ātrs, bet otrais-aizņēmies spēcīgs: fluorūdeņradis ir ātrs pirms sildīšanas, joda ūdens pat ar vāju sildīšanu tiek nogulsnēts uz joda un ūdens?
8. Pierakstiet pareizās reakcijas, kuru palīdzību varat doties uz:
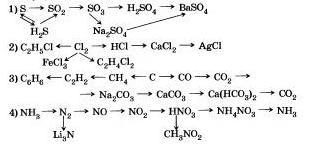
9. Pierakstiet līdzīgas reakcijas, kuru palīdzību varat doties uz:
12. Caur spraugu, lai atriebtos 10 g šķidra nātrija, viņi izlaida 20 g ūdens. Yaka sil un kādā wyde?
Sugas: 0,25 mol NaHS.
14. Apstrādājot 30 g vapnyak ar sālsskābi, oglekļa dioksīdā tika uzņemti 11 g. Yaka Masova Chastka uz kalcija karbonātu dabiskajā vapņakā? Atbilde: 83,3%. 15. Zastosovana medicīniskā joda tinktūrā є 51% kristāliskā joda šķīdums etilspirtā. Yaky obsyag alkohols, jaka ietilpība 0,8 g / ml. vai jums ir jāsagatavo 250 g šāda izmēra?
Tips: 297 ml. 16. Silīcija, grafīta un kalcija karbonāta summa, kas sver 34 g, tika uzspridzināta ar nātrija hidroksīdu un apstrādāta ar 22,4 litriem gāzes (n.o.). Apstrādājot šādu summas daļu ar sālsskābi, tika noņemti 2,24 litri gāzes (n.U.). Apmeklējiet summas noliktavu.
Paraugs: 14 g 81: 10 g C; 10 g CaCO2.
17. Gāzveida amjaks ar tilpumu 2,24 l (n.u.) 20 g gruvešu fosforskābē ar masas daļu 49%. Yaka sil tika darīts, yaka її masa?
Tips: 11,5 g
19. Kāds amjaku tilpums ir nepieciešams, lai izvadītu 6,3 tonnas slāpekļskābes, kas nepieciešama 5%patēriņam?
Tips: 2352 m3.
20. Ar dabasgāzi, kuras tilpums ir 300 litri (n.u.), acetilēnu atdala ar lielu metāna daudzumu gāzē, 96%. Visnagte yogo obsyag, yaksho vyhіd produkts 65%.
Skats: 93,6 l.
21. Vispirms sāciet strukturālo formulu ogļhidrātos ar attiecību 1,862 un masas daļu ogleklī 88,9%. Šķietami, ka ogļhidrātos kopā ar amonjaka šķīdumu barotnes oksīds.
Nemetālu loma cilvēku dzīvē
Nemetālam cilvēku dzīvē ir liela nozīme, jo bez viņiem dzīve nav naidīga ne tikai cilvēkiem, bet arī tiem dzīvajiem organismiem. Aje zavdyaki tā nemetāliski elementi, Jak skūpsts, akmeņoglēs, ūdenī un slāpeklī nostiprinās aminoskābes, šim laikam ir pudeles, bez kurām visiem nav iespējams dzīvot uz Zemes.
Ar cieņu aplūkosim zemāk redzamo attēlu, kurā attēloti pamata nemetāli:

Un tagad sīkāk sapratīsim nemetāla darbības un to nozīmes nozīmi, kā tās smaržo cilvēku dzīvē un organismā.
Tautas dzīve nav meklējama vecajās dienās, kā tas ir mājā, un katrā citā laikā ir daudz nemetālu un to zināšanu. Tiem, kuri ir zaudējuši mūsu ķermeņa funkcijas, viņi rūpējas par skūpstiem, un tiem pievieno slāpekli un citus gāzei līdzīgus vārdus, un viņi paši izmanto mūsu reibošos ieradumus. Arī bioloģijas gaitā jūs redzēsiet, ka visas ķermeņa funkcijas ir skaidri saistītas ar acīmredzamo skābumu.
Tā rezultātā iekļūšanu zobu UV viprominuvannya, par mūsu ķermeņa aizsardzību, ozona stavati.
Šāds nepieciešamais mikroelements, piemēram, sirka, cilvēku ķermenī ir minerālu skaistuma, kā arī strādnieku, škiru, nigty un matu lomā, lai kļūtu veseli. Tāpat tas nav aizmirstības jautājums, bet sirka rūpējas par izveidojušos skrimšļu un cistu audu likteni, palīdzot noslīpēt suglobu robotu, padarot mūsu audumus svarīgākus un svarīgākus cilvēku veselībai.
Anjoniem līdz hloram ir arī svarīga bioloģiskā loma cilvēkiem, jo tie piedalās fermentu aktivizēšanā. Ar palīdzības palīdzību es iegūstu draudzīgu vidusdaļu slinkumā un saņemu osmotisku saķeri. Hlors, kā likums, tiek patērēts cilvēku, virtuves sāls pavāru, organismā, kad viņi to saņem.
Ir daudz svarīgu īpašību, piemēram, nemetāli, ko tie uzliek cilvēka organismam, un viņi ir dzīvi ar organismiem, un tie ir stagnējoši un dažos jaunos.
nemetālu kolekcija
ūdens diena
Šāda veida nemetāli, piemēram, ūdens, tiek plaši izmantoti ķīmiskajā rūpniecībā. To izmanto amonjaka, metanola, hlora ūdens sintēzei, kā arī tauku hidrogenēšanai. Tāpat jūs nevarat iztikt bez ūdens līdzdalības, atjaunojot un virobnastikas gadījumā bagatokh metal un їkh z'udnan.
Ūdens tiek plaši izmantots medicīnā. Ārstējot brūces un citu asiņošanu, rodas peroksīda peroksīda trioksīds.
hlors
Sālsskābes, gumijas, vinilhlorīda, plastmasas, kā arī organisko atkritumu ražošanai izmantojiet hloru. Yogo vikoristovuyut šādos solījumos, piemēram, tekstilizstrādājumi un dokumenti, piemēram, jauktā mētelis. Pamatojoties uz cauruļvadiem, hlors ir neaizstājams dzeramā ūdens inficēšanai, tāpēc ar volodīma oksīdiem tas ir vairāk dezinficējošs efekts. Ar šādu jaudu, ūdeni un hloru, un ūdeni.
Medicīniskiem nolūkiem, kā likums, fizrozchin, nātrija hlorīds tiek vicorizēts. Pamatojoties uz to, tie vibrē daudz ūdens šķidrumu.
sirka
Šāds nemetāls, jaku sirka, vicoristovuyt sirchanoīnskābes, šaujampulvera, sirnikiv ražošanai. Ir iespējams arī iesaldēt gumijas vulkanizācijas laikā. Palieciet mājās ar barvnikiem un luminoforiem. Un koloidālā sirka ir nepieciešama medicīnā.
Syrka zināja stāvi Silsko štatā. Ikor vikoristovuyut, jaku fungicīds, cīņai ar bērniem.
Polimēru materiālu sintēzē, kā arī citu medicīnisko preparātu pagatavošanā plaši tiek izmantoti tādi nemetāli, kā jods un broms.







