Ūdeņražskābe plus skābe. Otrimannya sirkovodnyu
VĒRTĪBA
Sirkovodenє bezmieža gāze ar raksturīgu sapuvušas pudeles smaku.
Laikapstākļiem ļoti svarīgi ir paaugstināties pie -60,3 o С un grūtāk pie -85,6 o С.
2H 2S + 3O 2 = 2H 2 O + 2SO 2.
Ja ūdens pusē ienes aukstu priekšmetu, piemēram, porcelāna krūzi, tad temperatūra uz pusi būtiski pazeminās un ūdens oksidējas tikai līdz baltajam ūdenim, kas ar saldūdens acīm nosēžas uz bļodas. :
2H 2S + O 2 = 2H 2O + 2S.
Sirvodden ir viegli aizmigt; jogo summa ar dienas miju. Sirvodden ir vēl vairāk otruyny. Triviāla zithannya povitrya, kā atriebties gāzei no maziem daudzumiem, ļauni svarīga vilšanās.
Pie 20 o W, viens tilpums ūdens razchinyaє 2,5 tilpums ūdens. Rozchin sirvodnu pie ūdens jāsauc ar ūdeni... Stāvot uz pagriezieniem, īpaši uz gaismām, sirvodnevoy ūdens drīz būs sirka kalamutnoy forma, lai jūs to varētu redzēt. Tse vіdbuvaєtsya kā rezultātā oksidēta ūdens skābu pārtiku.
Otrimannya sirkovodnyu
Plkst paaugstināta temperatūra sirka vzaєmodin s vodnem, fiksējot gāzi sirvodin.
Praktiski sirūdens tiek izmantots, lai šķīdinātu citus skābju atšķaidījumus uz sausa metāla, piemēram, uz sulfīda sāls:
FeS + 2HCl = FeCl 2 + H 2 S.
Tīru ūdeni var attīrīt ar CaS, BaS vai A1 2S 3 hidrolīzi. Tīrākā gāze plūst tiešā reakcijā ūdenī un ūdenī 600 ° C temperatūrā.
Spēka ķīmija
Rozchin sіrvodnuyu vіdі mak vіdlivostі skābi. Sirwater ir vāja divvērtīgā skābe. Vona disossiu stupі bieži un galvenokārt pirmajā shchableі:
H 2 S↔H + + HS - (K 1 = 6 × 10 -8).
Disociācija citā līmenī
HS - ↔H + + S 2- (K 2 = 10 -14)
skaitītājs atrodas mazākajā solī.
Sirevodn ir spēcīgs līderis. Kad spēcīgi oksidējoši vīni tiek oksidēti līdz sēra dioksīdam vai sērskābei; oksidēts glibīns, lai nogulsnētu pēc notekas veida: temperatūra, pH diapazons, oksidētāja koncentrācija. Piemēram, reakcija ar hloru izraisīs reakciju uz sālsskābes šķīdumu:
H 2 S + 4Cl 2 + 4H 2 O = H 2 SO 4 + 8 HCl.
Vidējos sāļus sauc par sulfīdiem.
Zastosuvannya sirvodnya
Zastosuvannya sirkovodnyu, lai beigtos ar apvienošanos, kas iepriekš ir saistīta ar augstu toksicitāti. Laboratorijas praksē iegūtās zināšanas par uzglabāšanu ir svarīgu metālu nogulsnes. Pasniedz, lai kalpotu kā siruvīns sirhānskābes izvadīšanai, sirka elementārajā viglyadā un sulfidīvs
Uzstādiet uzdevumus
1. PIELIKUMS
| Zavdaņa | Pārliecinieties, ka jums ir nedaudz svarīgāka ūdens H 2 S. |
| Lēmums | Gāzei dotās masas izmaiņu pret gāzes masu, kas ņemta tajā pašā sistēmā, tajā pašā temperatūrā un vienā un tajā pašā skrūvē, citā veidā sauc par pirmās gāzes pieļaujamo jaudu. Indikatora lielums parāda, ka ir izveidojusies pirmā gāze, kas ir svarīga vai nokrīt citai gāzei. Parastā molekulmasa tiek ņemta vismaz 29 (ar urahuvannya slāpekļa, skābu un citu gāzu vietā). Tas nozīmē, ka izpratne par "pārtikas acīmredzamo molekulmasu" vikoristovayutsya gudri, mazliet par labu gāzes daudzumu. D gaiss (H 2 S) = M r (H 2 S) / M r (gaiss); D gaiss (H 2 S) = 34/29 = 1,17. M r (H 2 S) = 2 × A r (H) + A r (S) = 2 × 1 + 32 = 2 + 32 = 34. |
| Skatīt | H 2 S hidrohlorīds ir svarīgs pagriezienam 1,17 reizes. |
2. PIELIKUMS
| Zavdaņa | Zināt ūdens procentuālo daudzumu gāzes daudzumā, pie kura laukuma tilpuma ūdens kļūst par 20%, ūdens - 40%, ūdens - ūdens - 40%, ūdens - ūdens H 2 S. |
| Lēmums | Dažas gāzes daļas ir piepildītas ar molāru, tobto. ar dažu vārdu daļām, mantojumu cenas no Avogadro likuma. Es zinu, es notīrīšu summas molekulmasu: M r nosacīts (maisījums) = φ (O 2) × M r (O 2) + φ (H 2) × M r (H 2) + φ (H 2 S) × M r (H 2 S); |
| Parametra nosaukšana | Vērtība |
| Raksta tēma: | Sirkovoden |
| Kategorija (tematiskā kategorija) | Izmeta, ka zvaryuvannya |
Otrimannya sіrki
Jautrās autoritātes sirki
Istabas temperatūrā ūdens nonāk reakcijā no dzīvsudraba. Ar temperatūras regulēšanu aktivitāte tiek ievērojami palielināta. Sildot, sistēma nereaģē uz vidu vienkārša saruna, Iekšējo gāzu, slāpekļa selēna, telūra, platīna zelta, irīdija un joda vīnam. Sulfidi slāpeklis un zelts tiek noņemti netiešā veidā.
- Saistība ar metāliem
Syrka viyavlya jaudas oksidēšana, mijiedarbības rezultātā tiek iestatīti sulfīdi:
- Vzamodia ar ūdeni paaugstinās līdz 150-200 ° С:
H2 + S = H2S.
- Vzaєmodiya z kisnem
Ūdens sadeg skābē 280 ° C, savukārt 360 ° C temperatūrā, pie kuras tiek iestatīta oksīdu summa:
S + O2 = SO2;
2S + 3O2 = 2SO3.
- Kombinācija ar fosforu un oglekli
Sildot bez strāvas, ūdens reaģē ar fosforu, oglekli, oksidēto jaudu:
2P + 3S = P2S3;
- Kombinācija ar fluoru
Spēcīgu oksidētāju klātbūtnē ir šādas spējas:
S + 3F2 = SF6.
- Vzaєmodiya zі locīšanas vārdi
Savienojot ar syrka saliekamajiem vārdiem, tas ir kā svins:
S + 2HNO3 = 2NO + H2SO4.
- Nesamērīga reakcija
Syrka ir veselīga pirms nesamērīgām reakcijām, kad tiek konstatēta mijiedarbība ar pļavu, sulfidīdiem un sulfātiem:
3S + 6KOH = K2S +4O3 + 2K2S-2 + 3H2O.
- 3 vietējās rūdas
- Sildot bez piekļuves pārtikai
FeS 2 = FeS + S.
- Ūdens oksidēšana skābuma trūkuma gadījumā
2H2S + O2 = 2S + 2H2O.
- No metalurģijas un koksa krāšņu izplūdes gāzēm ar karsēšanu katalizatora klātbūtnē
H2S + SO2 = 2H2O + 3S.
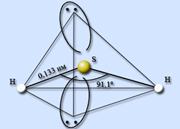
Vodneve z'єdnannya sirki - sirūdens H2S ... Sirvodns ir kovalenti z'єdnannya. Molekulas ir analogas ūdens molekulām, ūdens atoms tiek pārnests no sp 3-hibridizācijas stadijas, bet ūdens molekulas nepieņem ūdens molekulas. Atom sirki mensh elektronegatīvs, nіzh atom sisnyu, maє lielāks izmērs es, jaku mantojums, es mainu biezo lādiņu. HSH valences griezums kļūst par 91,1 °, un H-S josla kļūst par 0,133 nm.
Sirvododens ir liecinieks, ka vidi. Kategorijas "Siroden" klasifikācija un īpatnības 2014, 2015.
Cich komponentu bilances krājumi tiek glabāti laukā gāzes, gāzes kondensāta, gāzes un naftas piegāžu robežās, kur: - uzglabāt gāzes rezerves pie piegādēm ne mazāk kā 10 miljardi m3; - cich komponentu krājumi vīna dārzu ražošanā nekļūst ...
Otrunnya neidentificēts rіdinami Vzhivannya pomilkovo nenormāli, atbalstīts, scho etylovy (kharchoviy) alkohols vai ūdens, nav iespējams ražot rіdin, kamēr organisms nav nogriezts. Šādas gliemeža pazīmes: b_l pie šlunku, šlunku izmežģījums, ....
Mazs. 2.4. Viparnik Mal. 2.3. Desorber Mal. 2.2. Absorber mazs. 2.5. Siltummainis "caurule caurulē" Zemas temperatūras atdalīšanas metodi plaši izmanto: gāzes sausināšanai; redzēt kondensātu no gāzes kondensāta ģints uz ....
UZ GĀZI UZ ILGĀM TRANSPORTĒM. PĀRTIKA ŠĪ PREPARĀTA TĪRĪŠANAI ROZDIL 1 Att. 2. Maģistrālā cauruļvada izolācija Dabasgāze, kur tā nāk no dziļajām bedrēm, lai atriebtu cieto daļiņu (smilšu, katlakmens), kondensāta ...
Jautrās autoritātes Fiziskais spēks Asprātīgajiem prātiem sirvodden ir gāze bez kūts, jo ir spēcīga raksturīgā puvušu olu smaka. Tm = -86 ° С, Ткіп = -60 ° С, tas ir sapuvis pie ūdens, pie 20 ° С 100 g ūdens tiek izvadīts 2,58 ml H2S. Duzhe otruyna, kad ieelpo wiklikє ....
Sirvodnyu Sirvodn molekula ir nešķūņa gāze ar puvušu olu smaku. Ir labi doties uz ūdeni (20 ° C temperatūrā 1 ūdens tilpumā tas ir 2,5 tilpumi ūdens). Ūdeni var noraidīt bez viduvēja ūdens padeves ar ūdeni, kad tas tiek uzkarsēts, vai arī to var saukt ...
Jautrās autoritātes
Fiziskais spēks
Asprātīgajiem prātiem sirvodden ir gāze bez kūts, jo ir spēcīga raksturīgā puvušu olu smaka. T pl = -86 ° C, Tķīpa = -60 ° C, sapuvis ūdenī, 20 ° C temperatūrā 100 g ūdens izšķīst 2,58 ml H 2 S. letāls rezultāts... Dabā var redzēt pie vulkānisko gāzu noliktavas, izlikties par garo un organisko organismu apspiešanu. Labs šķīdums ūdenī, trenējoties piefiksēšu vāju sālsskābi.
- Ir ūdens šķīdumsūdens ir vājš vājas divvērtīgās skābes spēkā:
H2S = HS- + H+;
HS - = S 2 + H +.
- Sire ūdens sadedzināt pie povitri Sinє pusm'ya. Savstarpēji savienotas piekļuves gadījumā tiek izveidots derīgs sertifikāts:
2H 2S + O 2 = 2H 2O + 2S.
Ar lielu piekļuvi pavarda pavardam ūdenim vajadzētu ražot pirms eļļas oksīda (IV) apstiprināšanas:
2H 2S + 3O 2 = 2H 2 O + 2SO 2.
- Sirkhovens spēj piegādāt jaudu. Viltus ūdeni no ūdens var oksidēt sausā ūdenī, tīra gāze ka sirhānskābe.
Piemēram, laimē zebarvlyu bromnu ūdeni:
H2S + Br2 = 2HBr + S.
vzaєmodі ar hlora ūdeni:
H 2 S + 4Cl 2 + 4H 2 O = H 2 SO 4 + 8 HCl.
Strum ūdeni var apdedzināt, vikoristu un svina oksīdu, tā kā reakcija uzrauga lielu siltumu:
3PbO2 + 4H2S = 3PbS + SO2 + 4H2O.
- Vzaєmodiyya sirkvodnyu іf sіrchistiem gāze vikoristovuyutsya ūdens noņemšanai no metalurģijas un sālsskābes virobniztva izejošajām gāzēm:
SO2 + 2H2S = 3S + 2H2O.
No cim procesa ir saistīta vietējās sēklas izveidošanās vulkānisko procesu laikā.
- Vienu stundu tīrai gāzei un ūdenim ejot cauri pļavai, tiek iestatīts tiosulfāts:
4SO2 + 2H2S + 6NaOH = 3Na2S2O3 + 5H2O.
- Atšķaidītas sālsskābes un zaliz(II) sulfīda reakcija
FeS + 2HCl = FeCl 2 + H 2 S
- Alumīnija sulfīda mijiedarbība ar aukstu ūdeni
Al2S3 + 6H2O = 2Al (OH)3 + 3H2S
- Tieša sintēze no elementiem lai redzētu, vai pāri izkusušajam ūdenim nav palicis garām:
H2 + S = H2S.
- Parafīna summas ielāde no sirkoy.
1.9. Ūdeņražskābe un sāļi
Ūdeņražskābe piesaistot visu vājo skābju spēku. Vona reaģē ar metāliem, metālu oksīdiem, bāzēm.
Jaku divvērtīgā skābe atjaunos divu veidu sāļus - sulfīds un hidrosulfīds ... Hidrosulfīdi ir piemēroti ūdens, sulfīdu un lietus zemes metāliem, kā arī svarīgu metālu sulfīdiem, kas praktiski nesagrauj.
Melno un melno metālu sulfīdi nav saliekami, sulfīdi parasti ir cietināti, piemēram, medi (II) sulfīds, niķelis un svins - melns, kadmijs, Indija, alva - zhovt, surmi - oranžs.
Jona sulfīda metāla M 2 S struktūra var būt līdzīga fluorīta tipam, ūdens dermālais atoms ir kubs ar 8 atomiem metālā un metāla dermālais atoms ir 4 sīrkijas atomu tetraedris. MS tipa sulfīdi ir raksturīgi zemes metāliem, un tiem ir nātrija hlorīda tipa struktūra, dermāls metāla atoms un virkne oktaedru izlādi no atomiem pirmajā pakāpē. Ar spēcīgāku kovalento raksturu metāla-syr saite tiek realizēta ar struktūru ar zemākiem koordinācijas numuriem.
Resnās zarnas metālu sulfīdi dabā tiek ražoti kā minerāli un rūdas, kalpo kā siruvīns metālu atdalīšanai.