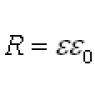Bp destilovaná voda. Toto je elektrická vodivosť vody. Voda ako vodič elektriny
Ako kontrolovať hladinu vody? Ľudia si túto diétu môžu sami nastaviť v rôznych situáciách. Tento článok obsahuje informácie o tom, ako pracovať v garážových systémoch.
Je možné, že niekomu sa jedlo môže zdať banálne. Čo, povedal som, vzal ohmmeter, tester (alebo multimeter s funkciou stmievacej podpory), strčil elektródy do vody a (čo tam bolo) zomrel.
Predtým, ako prehovoríme, podľa GOST-6709-72 "Destilovaná voda. Technické myslenie" je elektrická vodivosť destilovanej vody o niečo väčšia ako 5*10 -4 div/m = 5*10 -4 (Ohm*m) -1 . Inódy sa menia µS/cm: 5 µS/cm.
Musím povedať, že toto je bezpochyby ohmmeter. Alechi bude cítiť ako skutočná veľkosť vodnej podpory - to je skvelé jedlo. Napriek tomu bude súčet čísel na obrazovke multimetra (testera) jednoducho zanedbateľný.
Dekhto sa túla destilovaná vodaі chemicky čistá voda(destilát vysokej čistoty). Takže os, tse, akoby horela, nie bohato rôzne prejavy. V skutočnosti môžeme hádať, ako prekonať takzvanú „destilovanú vodu“? Správne - získajte pomoc od liehovarníka. Povedzme, že priemerný liehovar jednoducho nie je schopný vyrobiť chemicky čistú vodu. Na odstránenie zvyšku potrebujete špeciálne vybavenie a metódy čistenia. Niekedy sa destilovaná voda nazýva chemicky čistá.
"Zvichaina" destilovaná voda Je to vodič elektrickej energie (môže byť však potrebný vysoký elektrický výkon). Todi jaka Chemicky čistá voda- toto (ak však posudzujeme veľkosť napájanej elektrickej podpery, potom by sa pravdepodobne preniesla k vodičom napájania). Presnejšie povedané, elektrický prúd je možné viesť aj prostredníctvom prítomnosti OH - iónov a cez H + (presnejšie H 3 O + - nazývané hydróniové ióny), fragmenty ich molekúl a nie menej, čím sa vytvorí disociácia vati. . Tento elektrický výkon bude väčšinou vyrovnaný s výkonom „primárnej“ (napríklad destilovanej vody v destilátore alebo priemyselnej destilácie) destilovanej vody. Podiel molekúl, ktoré boli disociované v chemicky čistej vode, je veľmi malý, najmä pri izbovej teplote. Preto môže byť ruský GOST-6709-72 "Destilovaná voda. Technické mysle" označovaný ako "primárna" destilovaná voda. A nie chemicky čisté.
Čo sa môže stať v mysliach domácností o potrebe vody vo svete?
Vpravo je, že nikto z ľudí sa veľmi nestaral o svoje zdravie. Je menej pravdepodobné, že budú hovoriť cez mobilné telefóny (a ak majú hovoriť, tak určite LEN cez handsfree, bez bluetooth, pretože Rozmovej, samozrejme, nezáleží na živote a/alebo smrti, ak neexistuje poškodenie tela, opuch alebo mozog, ale oči, to sa absolútne nedá obísť – napríklad koncová stanica na čísle 02, 03 alebo tak – ak nie je k dispozícii hands-free rukoväť), snažia sa pracovať v fungujúce mikrovlnné rúry, žite správny (kóšer) život, žite bezstarostne (nevyhnutne pohodlne a sami - na bezpečných miestach, športujte atď. Večné "" (a tiež jednoducho ... niekedy sa pred takýmito rečami nepozúva "s humorom" (presnejšie s hlúposťou, ako to bude konkrétnejšie). Vzhľadom na všetky pochybnosti však ide najmä o pravda o správnych „optimistoch“ (alebo „pesimistoch“) Rozmov hovoríme pre milovníkov zdravého spôsobu života (a len pre nich; základy iného kalibru môžu tento materiál pokojne preskočiť).
Zokrema, hovorme o čistej pitnej vode. Nie je žiadnym tajomstvom, že za posledných 20-30 rokov bola výživná voda na mnohých miestach zapečatená. Napríklad v metropolitnej oblasti Ufa „príspevok“ vpravo (pre miesto odovzdané do zásobovania vodou) poskytuje závod Kronoshpan. A nie každý je schopný prepraviť vodu z priateľských miest.
Môžete si kúpiť vodu?
Dekhto chce kupit vodu... Prote, je nejaka zaruka, ze kupena voda naozaj vyhovuje prezbrojenym (na papierovom ci polyetylénovom plavci... alebo aj na parkane) "certifikatu yakness"? My napríklad v meste Ufa predávame “destilovanú” (súdiac podľa nápisu na etikete fľaše) vodu určenú na plnenie autobatérií, ktorej základom je... 4x menej, menej regulovaná spoločnosťou GOST.
No zázračne pochopíte, čo sa s tými batériami stalo po tom, čo do nich úrady naliali takú vodu (ja som ich len vylial pri kanalizácii)... A o koľko neskôr sa na internete na rôznych automobilových fórach objavilo veľa čudných (resp. dokonca zlé) ) sliv o tých, ktorí hovoria, že je „nejasné“ rozbiť batérie. Dobrý deň, dobre, čo tam je - batéria. Možno si myslíte, že v dôsledku nalievania takejto „destilovanej“ vody sa veci pokazia. Nie je to také strašidelné: stačí zaplatiť 3...15 tisíc. trieť. (v cenách do konca roka 2016 rubľov) i - nová batéria vo vašich rukách (keďže hovoríme o pôvodnej batérii osobného automobilu). Je to blázon. A os zdravia človeka je oveľa dôležitejšia. Zdravie nie je autobatéria, ktorá je vo svojej podstate vážnou chorobou.
Alebo si mám kúpiť destilátor?
Preto si rozumní ľudia kupujú vlastné pálenice. Aby ste si teda doma pripravili výživnú vodu pre svoju domovinu. Navyše nie tie, ktoré sú nádržou (stojacou na plynovom sporáku) s rúrkami a cievkou... - ale to už je storočie. A - vážne, továrenské, s elektronickou keramikou, chladené atď. Dobrým výsledkom je napríklad pridanie a prevádzka liehovaru Durastil (pred rečou dobrá stránka; ako autor veľmi rešpektuje, zatiaľ čo sa ľudia hádajú o tom, že pitná voda je červená alebo nedestilovaná, je málo alebo veľa kyslosti v ňom a pod., je to len „Už je veľa osudov a je tam pocit dobra, čo chcú všetci ostatní v podobe veľkého srdca). Len si, prosím, nemyslite, že tu robia reklamu liehovarom. Nie, toto nie je reklama.
Ako ovládať vodu
Takže, keď je človek nútený piť len dobrú, čistú (destilovanú) vodu, výživa je okamžite v stávke: ako možno monitorovať úroveň tejto čistoty? Ako môžeme určiť, či je voda skutočne destilovaná alebo nie, povedzme, rozdrvená? Napríklad je možné vytvoriť spôsob, ako vibrovať elektrickú podperu. Samozrejme, v ideálnom prípade je potrebná chemická alebo hmotnostná spektrometrická analýza, alebo ešte lepšie. Pretože čím väčší je zdroj elektrickej energie, tým menej domov sa nachádza v blízkosti vody.
Tu sa samozrejme môžete vydať dvoma cestami. Prvá - továreň tse pridbati vimiryuvach podpora rіdin. Samozrejme, môžete urobiť nepríjemnú prácu, ak si pravidelne kupujete (alebo pijete) destilovanú (alebo čistenú) vodu. V niektorých krajinách sa to vyžaduje. V prvom rade však ide o finančné plytvanie. Iným spôsobom, prosím, vezmite na vedomie, že toto zariadenie, ležiace tu na polícii alebo v byte, obsadíme. Po tretie, toto zariadenie, ako každé iné, musí byť pravidelne kontrolované (aby sa zabezpečilo, že ukazuje skutočný faktický základ vody, a nie len nezmysly). Vezmite si moje slovo, že masaker „Číňanov“ ukáže skvelé fantastické výsledky vimírov v novom zariadení (v očiach technického humoru). Nehovorme o veciach, ktoré sa stali v skutočnom živote. Napríklad na internete je veľa informácií o tom, ako ľudia kupovali tieto „čínske“ zariadenia, ktoré tam zomreli a potom po zverejnení výsledkov boli dobrým zdrojom humoru pre chýbajúcich. Preto, úprimne povedané, myslíme vážne na takéto úpravy. Spoľahlivejšie a presnejšie by bolo pripraviť si vlastný, vlastnoručne vyrobený. Uistite sa, že viete ČO meriate a ČO ukazujú výsledky merania.
Druhý spôsob je oveľa jednoduchší: základ vody, vikorystu, doslova, dostupných materiálov a samozrejme, melodicky, u každého človeka, ktorý sa rešpektuje, môžete zistiť pomocou typu testera alebo ohmmetra (no, najmä arabskí šejkovia, Bill Brány tam... také zariadenie matka núdze 'jazyk... takže) úplne stačí žiť v palácoch s mohutnými smaragdovými stĺpmi orámovanými v zlate, piť tú najčistejšiu vodu, aká je na zemi, atď., nie o nich, ale o všetkých ostatných). Je pravda, že po troche porozumenia, čo urobíte? Je to naozaj nepríjemné.
Niekoľko teórií o elektrárni
Ako teda môžeme kontrolovať zásobovanie vodou (rovnako ako v ktorejkoľvek inej krajine)? V prvom rade je to teória. Vidíme napríklad kutila zo zahraničnej fyziky (Sivukhin D.V. Electrics: Základná učebnica.-2. roč., Vipr.-M.: Veda. Vedúca redakcia fyzikálnej a matematickej literatúry, 1983.-(pregraduálny kurz fyzika). -688 s.). I - podľa vzorca (46.5):
R - podpora stredu drôtu,
- dielektrický prienik stredom (voda),
- Pitoma elektrická vodivosť stredu,
C – kapacita elektródy.
Indexy „1“ a „2“ sú priradené prvej a druhej (prakticky) elektróde.
Tento vzorec je napísaný v Gaussovom systéme jednotiek (pre niektorých čitateľov je ťažké pochopiť, o aký systém ide). Uveďme práve ten vzorec, prevedený na primárny, simultánny systém C (štandardný systém jednotiek je ten, ktorý zaujíma väčšinu ľudí... Chcem povedať pár slov programátorom: nemýľte si tento systém s mojím programovaním C): 
8,854*10-12 f/m - elektricky konštantná. Dekhto to nazýva neustále dielektrické prenikanie vákua.
Tobto. Tu vpravo - v nádobách (a samozrejme aj v tvare) elektród, pomocou ktorých sa vibruje. Ideálny pád je sústredná guľa; trochu silnejšie, ale aj škaredé, - dlhé koaxiálne valce. V domácnosti je však dôležité pripraviť si oba typy elektród (no, aspoň veľa práce). To nie je nutné.
Najjednoduchšou možnosťou, ktorá sa dá ľahko implementovať doma, sú dve dlhé lineárne elektródy (len zdanlivo - dve veľmi tenké častice), ktoré sa nachádzajú na rovnakej línii.
Keď teda poznáme kapacity zomierajúcich elektród a vezmeme do úvahy, že stred prvej a ostatných elektród sú rovnaké, ako aj skutočnosť, že elektródy sú rovnaké, je možné určiť elektrickú podporu strednej elektródy. (v tomto prípade - p Idini - voda). Vzhľadom na to je vzorec jasnejší ako jednoduchý:
C - kapacita dvoch elektród (to je kapacita kondenzátora kombinovaná s dvoma elektródami). Predpokladáme, že čitatelia vedia, že existuje kapacita kondenzátora (ktorý obsahuje minimálne dve elektródy - platničky) a stáva sa, že je kapacita JEDNEJ elektródy braná vedľa seba. Veľa rôznych prejavov.
V prípade, že elektródy majú dve šípky, ich kapacitu je možné zapísať vo forme vzorca (26.9) (prevedené do systému CI): 
Ln - prirodzený logaritmus,
l - šípka dovzhina, zamknutá v rіdine, m,
h - stáť medzi šípkou, m,
a - polomer šípky, m-kód.
Tento vzorec je správny pre takéto mysle:
L >> h >> a
Vpravo je to, že ak význam mysle nie je dostatočne nastavený, môže sa vytvoriť vagomický prílev regionálnych efektov, ktoré prispievajú k výsledkom expanzie a skutočná hodnota kapacity sa môže líšiť od vyčerpanej kapacity. Okrem toho je vzorec odvodený od predpokladaného vzhľadu vodivého stredu bez kože (nad rámec veľkosti). Keďže zostávajúce rozmery (merané napríklad ako celkové rozmery nádoby obsahujúcej vodu) sú koncové, potom sa vzorec uvádza blízko hodnoty kapacity Z.
Nahradením tohto vzorca za podporu R môžeme vylúčiť: ![]()
V skutočnosti sa dielektrický prienik stredu skrátil; To znamená, že elektrická podpera neleží pod dielektrickým prienikom.
Prepíšme zostávajúci vzorec praktickým spôsobom pre praktickú prehľadnosť: ![]()
Čo si môžeme odniesť? Ako je známe množstvo elektrická podpora(Okhm), previnuté v Proja Vimyryuvan (ohmmeter, T. T. T. P.) pre pre-Housing of the Two of Thin, Dovgikh, Viddalenich jedna z tej istej elektródy, vädnutá v strede (voda), potom pre centrálny vzorec je vizuál viditeľné. Yak V už, melodicky, vieš, elektrické napájanie(napríklad) sa zobrazí nad Omah a Om*m. Na nahradenie lineárne rozšírených (šípkových) kovov a vodičov. Zdá sa, že elektrická vodivosť jednotky sa meria v (Ohm * m) -1.
Tento vzorec nám teda poskytuje jednoduchý spôsob Elektrická vodivosť vody pomocou metódy ďalšej ekvalizácie so štandardnými hodnotami. Na tento účel je potrebné vziať do úvahy parametre elektród a nádoby, v ktorej sa voda (voda) nachádza. Takže sme sa umyli, čo môžeme robiť?
l >> h >> a
Tobto. Životnosť elektród môže byť oveľa väčšia, ale medzi nimi je menej miesta; a zvyšok je svojím spôsobom oveľa väčší pre polomer kože z elektród. Naša prax má napríklad tieto parametre:
L = 10 cm
v = 1...2 cm
a = 0,1 div.
Samozrejme je možné použiť adekvátnejšie hodnoty.
Veľkosť sudcu, v ktorej krajine sa nachádza, ktorý sa testuje, sa nemá brať do úvahy menej, ale má väčší význam. Je jasné, že čím väčší smrad, tým presnejšie budú výsledky vymierania. V našej praxi boli dosiahnuté uspokojivé výsledky a najmä odporúčam použiť dózu s objemom 0,7 litra.
Rešpekt: banka môže byť veľmi dôležitá, pretože hovoríme o usporiadaní elektrickej podpory destilovaná voda!! Mitya je, samozrejme, nevyhnutnosťou pre zvyšok sveta, a preto vymriete. čistá, destilovaná voda, Boh vám žehnaj, bez zbytočných nákladov. V zdĺhavej epizóde je pravdepodobné, že nádoby, ktoré zostali na stenách, adsorbované domy sa pokazia a vy sa nebudete spoliehať na destilovanú vodu, ale, zhruba povedané, na soľanku, ktorá bude zahŕňať všetky ostatné slová.
Teraz - o materiáli elektród. Vpravo, kedykoľvek zoberiete elektródu z obyčajnej medenej, kovovej (alebo preboha, hliníkovej) tyče, existuje záruka, že v krátkom čase sa ich elektrický potenciál zmení (v dedičstve elektrochemických procesov) a samozrejme, merané pomocou ohmmetra bude zdanlivo neskutočné. Preto sú v ideálnom prípade potrebné platinové alebo platinové elektródy. Kde ich máme vziať? A potom - aký je zmysel takýchto domácich „zákrutov“? Ešte jednoduchšie je kúpiť si hotové zariadenie, ktoré vám neumožní kúpiť platinové elektródy. Ale, našťastie nie je všetko také hladké.
Keďže neexistujú žiadne platinované, k dispozícii sú aj pozlátené. Na extrémnom konci vo všeobecnosti siahame po poniklovaných, pochrómovaných, nerezových (napríklad štandardné pletacie ihlice s priemerom 1...2,5 mm). Keďže neexistujú žiadne chrómované (niklované) pletacie ihlice, môžete si konečne kúpiť pár nerezových zváracích elektród s priemerom 2...2,5...3 mm. Dôkladne ich očistite tavidlom, trochu obrúste jemným brúsnym papierom, potom jemným brúsnym papierom. Alebo použite šípku z nehrdzavejúcej ocele s malým priemerom. Dúfame, že čitateľ vie, ako používať posuvné meradlo a dokáže určiť priemer ihly a pletacej ihly. A môžete počítať aj jej veno - to, ktoré zostane uväznené vo vode (vode) počas procesu vyhynutia.
Týmto spôsobom je o Vimíroch všetko jasné. Vezmime si čistú (!) nádobu s objemom 0,7 litra (alebo ešte lepšie 1…2…3 litre) a získame aj dva kusy vhodnej nádoby s malým priemerom. Potom do pohára nalejeme vodu na skúšku. Tam ukotvíme dve šnúry (elektródy) v rovnakej hĺbke, rozložíme ich v dostatočnej vzdialenosti jedného typu (aspoň 4...5 polomer šípu). Elektródy, ktoré nie sú elektricky vodivé, je potrebné vŕzgať, pretože sú dobre viditeľné (napríklad pretlačením cez dve tenké plastové platne). Potom k elektródam pripojíme tester (ohmmeter) a zmeriame údaj (Ohm). Po tomto procese sa určí hodnota elektrickej vodivosti vody, ktorá je vyjadrená v (Ohm*m) -1.
Čo povedať GOST
Teraz nie je potrebné kontrolovať s GOST a kontrolovať, aká čistá (jasne destilovaná) voda je testovaná. Bez toho, aby sme boli hlúpi, nechajme sa prekvapiť tým, čo pre nás reguluje DERZHSTANDARD 6709-72 „Destilovaná voda. Technické mysle“. Takže v odseku „1. Technické detaily“ si môžete prečítať: Elektrická vodivosť pri 20 °C: nie viac ako 5 * 10 -4 cm/m. Dobre vieme, že 1 cm (Siemens) = 1/Ohm. Tobto. domáce zvieratko elektrická vodivosť destilovanej vody môže byť 5*10-4 (Ohm*m)-1.
Predtým, ako budeme hovoriť, by sme chceli zistiť, ako blízko je hodnota k tomuto parametru GOST destilovaná voda, destilované destilátormi (Durastil, ako aj iné, vrátane domácich filtrov pre domácnosť). A čo „fotky mesačného svitu“? Ak chcete vykonať vyblednutie, dajte nám vedieť o výsledkoch.
Čo je v praxi
Naša prax to ukazuje. Elektrická vodivosť tzv "destilovaná voda pre autobatérie (virbológia - rieka Ufa) bola 24,5 * 10 -4 (Ohm * m) -1, potom. Maximálne 4 je na štandard priveľa. Pred rozprávaním chutila táto voda ako studničná voda, ale vôbec nie destilovaná. Ak ste to vyskúšali, budete vedieť: destilovaná voda má svoju horkú chuť. Rovnako ako dobre varená voda chutí ako „myak“. Ymovirno, áno "destilovaná voda bol zachytený na nejasnom filtri, čo bolo urobené svojským spôsobom.
Elektrická vodivosť vody filtrovanej osmotickým filtračným filtrom (vikorystový odpadový filter, ktorý bol spracovaný 3x v byte pre dve osoby) bola 18,7 * 10 -4 (Ohm * m) -1. Bohužiaľ, značka filtra nie je známa. Každopádne, v každom prípade ide o filter, ktorý sa dá zaradiť do kategórie obľúbených.
Voda podrobená domácemu cyklu „zmrazená - nezmrazená“ (pravdepodobne okrema Rozmova) vykazovala elektrickú vodivosť 9,3 * 10 -4 (Ohm * m) -1. Tobto. Táto hodnota elektrickej vodivosti je veľmi blízka spoľahlivému parametru GOST. Elektrická vodivosť vody z vodovodu je 125,3 * 10 -4 (Ohm * m) -1. To znamená, že v domácnosti si zmrazovaním a rozmrazovaním vody pripravíte čistú vodu ako na výživové účely, tak aj na technické účely, napríklad do batérií. Okrem toho to znamená, že bola oznámená vyššia metóda, ktorá je úplne vhodná na rýchlu diagnostiku elektrickej vodivosti vody.
Schopnosť elektrolytov stať sa vodičmi, keď sú napájané elektrickým prúdom, sa nazýva elektrolytická elektrická vodivosť. Pozrime sa na soľné a kyslé elektrolyty, ako aj na zásadité elektrolyty, ktoré sú prítomné vo vode. Tieto slová sú v rozpore so skutočnosťou, že koncentrácia aniónov (záporne nabitých iónov) a katiónov (kladne nabitých iónov) v dôsledku elektrolytickej disociácie 2 je vysoká. Elektrické komponenty sa prenesú na iný typ vodiča. Ich vodivosť v elektrickom poli na úkor prvej skupiny vodičov je určená aktivitou iónov.
Vodiče idú až po podperu (R). Podľa Ohmovho zákona je hodnota priamo úmerná veku vodiča ( l ) a je úmerná štvorcu (S) rezu. Koeficient proporcionality - ukazovateľ napájanej podpery (ρ) vodiča dĺžky centimetra s priečkou 1 cm2:
Elektrická vodivosť sa udáva v cm (S) a vyjadruje sa v jednotkách systému CI – v Siemensoch. Môžeme povedať toto: Ohm −1 = kg −1 .m −2 .s 3 A 2 .
Samostatné elektrická vodivosť napájacieho zdroja ( K- kappa) ta molárv žiadnom prípade ekvivalent ( Λ - lambda) 3 .
Poznámka 1: Koncentrácie sú vypočítané v gramoch na kilogram.
Poznámka 2:Termín "elektrolytická disociácia" označuje čiastočný alebo úplný rozpad molekúl na katióny a anióny sa rozkladajú na molekuly.
Poznámka 3: Neodporúča sa používať výraz „ekvivalentná elektrická vodivosť“. Rámec je pokyn zostavený Komisiou Únie čistej a aplikovanej chémie. Medzinárodná elektrochemická nomenklatúra IUPAC prijala tento termín „molárna elektrická vodivosť“.
1. Elektrická vodivosť
Zvíťazili sme pri realizácii brnkania za účelom kvalitnej dodávky elektriny. K dispozícii je brána napájanej podpory - indikátor štruktúry, ktorý vypĺňa priestor medzi elektródami s plochou 1 cm 2, umiestnený jeden po druhom v centimetrovej vzdialenosti:


Táto hodnota je určená povahou elektrolytu, jeho teplotou a nasýtenosťou. Elektrická vodivosť sa preto zvyšuje v dôsledku zmien teploty, čo je významná vlastnosť takýchto elektrolytov v porovnaní s vodičmi prvého druhu. Tekutosť iónov sa zvyšuje znížením solvatácie iónov a zmenou viskozity.
Obr. 1 jasne ukazuje, ako sa mení elektrická vodivosť zdroja v závislosti od koncentrácie poškodenia. Jednotkou merania tejto hodnoty je S/m - siemens na meter (1 S/m = 1 Ohm-1m-1). Najčastejšie používaná hodnota je µsm/cm.
V dôsledku zvýšenej saturácie sa elektrická vodivosť obličky zvyšuje a pri dosiahnutí maxima sa mení. Je potrebné poznamenať, že zatiaľ čo silné elektrolyty sú prítomnosť jasne vyjadrené, zatiaľ čo slabé elektrolyty sú oveľa slabšie. Prítomnosť silných rozdielov ukazovateľov s hraničnými hodnotami na krivkách hovorí o tom, že tekutosť toku iónov v zriedených elektrolytoch od ich nasýtenia leží nevýznamne a spočiatku sa zvyšuje v priamej úmernosti. So zvyšujúcou sa koncentráciou interakcie iónov dôjde k zvýšeniu tekutosti kvapaliny. Maximálny bod na krivke slabého elektrolytu je spôsobený znížením stupňa disociácie a zvýšením koncentrácie. Po dosiahnutí saturácie piesne koncentrácia stúpa viac a viac, nižšie ako počet iónov v zdroji. Na opísanie prílevu iónovej interakcie a saturácie elektrolytov na ich elektrickú vodivosť použijeme pojmy „molárna elektrická vodivosť ».
2. Molárna elektrická vodivosť
Λ (Elektrická vodivosť je molárna- div. približne. 4) - veľkosť, obalená okolo nosiča elektrolytu pre vodič s namiesto 1 mol roztoku, ktorý bol umiestnený medzi elektródy, inštalovaný v jednom smere v centimetrovej vzdialenosti. Na určenie vzťahu medzi molárnou elektrickou vodivosťou, molárnou koncentráciou (M) a elektrickou vodivosťou (K) bol vyvinutý nasledujúci vzťah:

Poznámka 4: Dodajte elektrolytu elektrickú vodivosť 1N volalekvivalent (Λ = 1000 Predtým /N). Koncentrácia (N) je vyjadrená v g-ekv/l. Pokyny IUPAC však neodporúčajú používať výraz „ekvivalentná elektrická vodivosť“.
Molárna elektrická vodivosť silných aj slabých elektrolytov postupuje s klesajúcimi koncentráciami (to znamená, že s klesajúcou saturáciou (V = 1/M) sa ich elektrická vodivosť pohybuje). Vaughn dosiahne hraničný displejΛ 0. Toto maximum možno pomenovaťmolárna elektrická vodivosť pri nenarušenom zriedení
 Pre slabé elektrolyty (obr. 2) je koncentrácia tejto hodnoty vo vzťahu ku koncentrácii určená predovšetkým vzostupom disociačného štádia, čo vedie k zriedeniu elektrolytu. V silných elektrolytoch so zníženou saturáciou je interakcia iónov oslabená. Intenzita ich pohybu sa zvyšuje, čerpajúc na sebazvýšená molárna elektrická vodivosť.
Pre slabé elektrolyty (obr. 2) je koncentrácia tejto hodnoty vo vzťahu ku koncentrácii určená predovšetkým vzostupom disociačného štádia, čo vedie k zriedeniu elektrolytu. V silných elektrolytoch so zníženou saturáciou je interakcia iónov oslabená. Intenzita ich pohybu sa zvyšuje, čerpajúc na sebazvýšená molárna elektrická vodivosť.
Výskum F. Kohlrauscha ukazuje, ako šupky iónov prispievajú k molárnej elektrickej vodivosti elektrolytov pri nekonečne zriedených hladinách (obmedzené riedenie). Je dôležité, že λ0 (hraničná iónová vodivosť) je súčet molárnej elektrickej vodivosti, ktorú demonštruje katión a anión, ako aj vizuálny vzoreczákon nezávislosti vládcu iónov:
Pri nenarušenom riedení elektrolytu je molárna elektrická vodivosť rovnaké množstvo katiónových a aniónových zlúčenín v elektrolytickej distribúcii:
Λ 0 = K 0 + + K 0 - (4)
3. Faktory, ktoré určujú rozdiely v elektrickej vodivosti
Koncentrácia soli a teplota sú hlavné faktory, ktoré určujú elektrickú vodivosť vody. Hlavné prírodné zásoby minerálnej vody sú:
katióny K+, Na+, Mg2+, Ca2+;
Anióny HCO 3-, Cl-, SO 4 2-.
Iné prítomné ióny (Al 3+, Fe 3+, Mn 2+, Fe 2+, H 2 PO 4 -, NO 3 -, HPO 4 2-) a ich infúzia do elektrickej vodivosti je nesieťová a dokonca sa uvažuje ich miesto vody málo. Hodnoty elektrickej vodivosti umožňujú posúdiť úroveň rebarbory a mineralizácie. V prírode sa elektrická vodivosť vody zvieratka stáva 100-2000 μsm/cm s mineralizáciou od 50 do 1000 mg/l (pri atmosférických zrážkach -10-120 μsm/cm s mineralizáciou 3-60 mg/l).
4. Elektrická vodivosť. Vykonávanie rozrakhunkіv
Statické vzorce 3 a 4 a indikátory iónovej elektrickej vodivosti, ktoré sa vám črtajú pod rukou ( TO), je možné vyvinúť elektrickú vodivosť ( Predtým іΛ ) z akéhokoľvek dôvodu:
K = (K + + K - ) M/1 000 (5)
Z informácií v tabuľke 1 môžete zistiť iónovú a hraničnú iónovú elektrickú vodivosť charakteristickú pre ióny, ktoré často konvergujú v zriedených oblastiach (teplota +18°C).
stôl 1

Zadok 1: Je potrebné vypočítať napájanie (K). Rozchin KCl (chlorid draselný) 0,0005 m.
rozhodnutie: Disociácia KCl vo vodných rastlinách prebieha na iónoch K+ a Cl-. Na základe údajov uvedených v tabuľke 6 poznáme ukazovatele elektrickej vodivosti pri 18°C pre šľachtiteľské odrody:
Koncentrácia K+ - iónov 0,0005 M (λ = 63,7 Ohm -1. cm 2. mol -1);
Cl - - Koncentrácia iónov 0,0005 M (λ = 64,4 Ohm -1. cm 2. mol -1).
Ak je potrebné vyvinúť poruchu prívodnej elektrickej vodivosti elektrolytického roztoku, ktorý obsahuje zmes rôznych iónov, vzorec nadobudne nasledujúci vzhľad:
k = Σλ i Mi /1000 (6)
Výpočet, s Buďte opatrní so silnými elektrolytmi. A pred slabými rozpadmi dôjde rýchlo k ďalšiemu vývoju spojenému s meniacimi sa disociačnými konštantami a významnou saturáciou voľných iónov. Molárna elektrická vodivosť, napríklad rozklad 0,001 M kyseliny octovej -Λ = 41 Ohm-1.cm2.mol-1 (18 °C), ak vzorec (6) stagnuje, odvodí sa hodnota približne rovná 351,9 Ohm -1.cm 2.mol -1.
Zadok 2: Na rozpustenie 0,001 M kyseliny octovej (CH3COOH) je potrebné určiť elektrickú vodivosť (k) kvapaliny.
rozhodnutie: K disociácii slabých vodných zlúčenín kyseliny octovej dochádza na ióne CH 3 COO - a H + (CH 3 COOH ↔ H + + CH 3 COO -).
Konštantná - KCH 3 COOH = [H +]. /[CH3COOH].
Pre jednosýtnu kyselinu - [H+] = = x.
Nasýtenie disociovaných molekúl slabej kyseliny sa rovná počiatočnej koncentrácii, ktorá je ešte nižšia, a možno ju tiež považovať za rovnú M (M = 0,001 mol/l).
KSN3COOH = x2/M, KCH3COOH = 1,8. 10-5.
Za umývadlom: koncentrácia kyseliny 0,001 M (0,001 g-ekv/l).
Významné údaje o nasýtení iónov H + a CH 3 COO -, ako aj ich elektrickej vodivosti (λ n+ 0,001 = 311 Ohm -1. cm 2. mol -1, λ снсоо- 0,001 ≈ 40,9 Ohm -1. cm 2 - 1), vypočíta sa elektrická vodivosť "k".
k = (311 + 40,9). 0,001/1000 = 3,52,10 -4 Ohm -1 cm -1 (div/cm) alebo 352 μsm/cm.
Ak potrebujete opraviť indikátor „Elektrická vodivosť“, aby sa intenzita vody dostala na požadované normy, požiadajte o to špecialistov spoločnosti. Vodník. Poskytneme vám optimálnu technologickú schému na čistenie vody.
Elektrická vodivosť vody je pre našu pokožku veľmi dôležitá.
Ľudská pokožka si uvedomuje, že voda má spravidla elektrickú vodivosť. Ignorovanie tejto skutočnosti môže viesť k katastrofálnym následkom pre život a zdravie.
Je dôležité pochopiť elektrickú vodivosť kvapaliny a elektrickú vodivosť vody v kvapaline.
Elektrická vodivosť, t...
Skalárna veličina, ktorá charakterizuje elektrickú vodivosť reči a tradičný vzťah medzi silou prúdu elektrickej vodivosti a silou elektrického poľa.
Sila reči vedie elektrický prúd, ktorý sa v hodine nemení, vplyvom elektrického poľa, ktoré sa v hodine nemení.
Tlumachny slovník Ushakov
Elektrická vodivosť (elektrická vodivosť, pl. no, samica (ph.)) - schopnosť viesť, prepúšťať elektrinu.
Tlumachny slovník Ushakov. D.M. Ušakov. 1935-1940
Veľká polytechnická encyklopédia
Elektrická vodivosť alebo Elektrická vodivosť - sila reči sa vykonáva pod vplyvom elektrického poľa, ktoré sa nemení, elektrického prúdu, ktorý sa za hodinu nemení. E. p. je tvorený prítomnosťou zemských elektrických nábojov v reči - nosovej strumy. Typ toku je elektronický (pre kovy a vodiče), iónový (pre elektrolyty), elektrón-iónový (pre plazmu) a deliaci (s elektronikou) (pre vodiče). Z dôvodu dodávky elektrickej vodivosti sú všetky telesá rozdelené na vodiče, vodiče a dielektrika, fyzikálne. veľkosti, zabalené do elektrickej podpory. Jednotkou elektrickej vodivosti je Siemens (div.); 1 div = 1 ohm-1.
Veľká polytechnická encyklopédia - M.: Svit a osvita. Ryazantsev V.D.. 2011
Elektrická vodivosť vody, t...
Polytechnický terminologický slovník
Elektrická vodivosť vody je indikátorom elektrickej vodivosti vody, ktorá charakterizuje soli vo vode.
Polytechnický terminologický slovník. Usporiadanie: V. Butakov, I. Fagradyants. 2014
Námorný encyklopedický sprievodca
Elektrická vodivosť morskej vody – schopnosť morskej vody prúdiť pod prílevom vonkajšieho elektrického poľa je daná prítomnosťou elektrických nábojov – iónov rozpustených solí, najmä NaCl. Elektrická vodivosť morskej vody sa zvyšuje úmerne so zvýšením salinity a je 100 - 1000-krát väčšia ako vodivosť riečnej vody. Udržujte ju pri rovnakej teplote ako voda.
Námorný encyklopedický sprievodca - L.: Stavba lodí. Spracoval akademik N. N. Isanin. 1986
Z týchto bodov je zrejmé, že hodnota elektrickej vodivosti vody nie je konštantná, ale závisí od prítomnosti solí v nej a iných domoch. Takže napríklad elektrická vodivosť destilovanej vody je minimálna.
Ako určiť elektrickú vodivosť vody, ako ju uhasiť.

Konduktometria - meranie elektrickej vodivosti vody
Na rozvibrovanie elektrickej vodivosti vody sa používa metóda konduktometrie (hodnota je nižšia) a zariadenia, ktoré pomáhajú rozvibrovať elektrickú vodivosť, sú podobné metóde zvanej konduktometria.
Konduktometria, tse...
Tlumachny slovnik cudzich slov
Konduktometria, pl. nie nie (nemecky: Konduktometrie< лат. conductor проводник + греч. metreō мерю), тех., хим. — один из видов химического количественного анализа, основанный на измерении электропроводности исследуемого раствора при постепенном добавлении к нему исследуемого реагента.
Tlumačnyj slovník osobných slov od L. P. Krišina - M: ruský jazyk, 1998
Encyklopedický slovník
Konduktometria (z anglického vodivosť - elektrická vodivosť a grécky metroo - virtuálny) je elektrochemická metóda analýzy založená na virtuálnej elektrickej vodivosti problémov. Na udržanie koncentrácie solí, kyselín, zásad kontrolujte zásoby rôznych priemyselných produktov.
Encyklopedický slovník. 2009
Určte elektrickú vodivosť vody
Doplním výpočet hodnoty elektrickej vodivosti prívodu na rôzne druhy vôd*.
Potom elektrická vodivosť vody, t...
Poradca technického prekladu
Potom elektrická vodivosť vody je elektrická vodivosť jednotky objemu vody.
[GOST 30813-2002]
Elektrická vodivosť vody*:
- Voda z vodovodu – 36,30 µS/m;
- destilovaná voda – 0,63 µS/m;
- Pitna (butylovaná) – 20,2 µS/m;
- Pitna vimorozhena – 19,3 µS/m;
- Vodoprovidna zmrazená – 22 µS/m.
* Článok “Elektrická vodivosť vzoriek pitnej vody rôznych úrovní čistoty” Autor: Ľudmila Borisivna Vorobyova. Časopis: “Interexpo Geo-Sibir Vydanie č. 5/ročník 1/2012.”
Mineralizácia
Súhrn všetkých zistení pri chemickom rozbore minerálnej vody; sa môže objaviť v mg/dm 3(do 1000 mg/dm 3) ta ‰ (nad 1000 mg/dm 3).
Veľa vibrácií, vidiecka nadvláda, podniky zásobovania pitnou vodou vydávajú piesne vody, sokremácia, pred mineralizáciou, úlomky vody, ktoré pomstia veľké množstvo solí, negatívne prúdia do rieky A vytvorené organizmy, technológia výroba a viskozita produktov spôsobujú tvorbu vodného kameňa na stenách. kotly, korózia, zasoľovanie pôdy.
Klasifikácia prírodných vôd s mineralizáciou .
|
Mineralizácia, g/dm 3 |
|
|
Ultra-čerstvé |
< 0.2 |
|
Čerstvé |
0.2 - 0.5 |
|
Voda s výrazne zvýšenou mineralizáciou |
0.5 - 1.0 |
|
Solonuvati |
1.0 - 3.0 |
|
Soloni |
3 - 10 |
|
Voda so zvýšenou slanosťou |
10 - 35 |
|
Rozsoli |
> 35 |
Elektrická vodivosť
Elektrická vodivosť - na základe číselného vyjadrenia prívodu vody sa uskutočňuje elektrický prúd. Elektrická vodivosť prírodnej vody závisí najmä od koncentrácie rozpustených minerálnych solí a teploty. Prírodné vody sú dôležité pri distribúcii silných elektrolytov. Minerálnu časť vody tvoria ióny Na+, K+, Ca 2+, Cl-, SO 4 2-, HCO 3-. Tieto ióny určujú elektrickú vodivosť prírodných vôd. Prítomnosť iných iónov, napríklad Fe 3+, Fe 2+, Mn 2+, Al 3+, NO 3 -, HPO 4 -, H 2 PO 4 -nemá veľký vplyv na elektrickú vodivosť, pretože sa nenachádzajú v blízkosti vody vo významných množstvách (napríklad pod vypúšťaním priemyselných alebo vládnych odpadových vôd). Na základe hodnôt elektrickej vodivosti prírodnej vody možno približne posúdiť mineralizáciu vody predchádzajúcim založením ložísk.
Ťažkosti, ktoré vznikajú pri hodnotení celkových namiesto minerálnych látok (mineralizácia) v dôsledku elektrickej vodivosti, sú spojené s:
1. rozdielna elektrická vodivosť rôznych solí;
2. zvýšená elektrická vodivosť v dôsledku zvýšenej teploty.
Hodnota dodávanej elektrickej vodivosti slúži ako približný ukazovateľ aktuálnej celkovej koncentrácie elektrolytov, najmä anorganických a používa sa v programoch na sledovanie stavu vodného média na hodnotenie mineralizačnej vody. Elektrická vodivosť je jednoduchým súhrnným ukazovateľom antropogénnej aktivity.
Teplota
Teplota vody vo vodnom útvare je výsledkom mnohých procesov prebiehajúcich súčasne, ako je slnečné žiarenie, vyparovanie, výmena tepla s atmosférou, prenos tepla prúdmi, turbulentné miešanie vody atď. Keď sa voda zahreje, zviera je nútené dole. Rýchly a dodatočný rozdiel teploty vody na povrchu a v hĺbke je určený množstvom tepla, ktoré sa dostane na povrch, ako aj intenzitou a hĺbkou miešania. Dodatočné zmeny teploty môžu dosiahnuť niekoľko stupňov a preniknúť do malej hĺbky. V mliečnych vodách je amplitúda teploty vody blízka rozdielu teploty povrchu.
Teplota vody je najdôležitejším faktorom, ktorý ovplyvňuje fyzikálne, chemické, biochemické a biologické procesy prebiehajúce vo vodnej ploche, v ktorej významnom svete spočíva oxidačný režim a intenzita Neprebiehajú žiadne samočistiace procesy. Hodnoty teploty sa používajú na výpočet stupňa nasýtenia vody kyslosťou, rôznymi formami vody, tvorbou uhličitanovo-vápenatého systému s bohatými hydrochemickými, hydrobiologickými, najmä limnologickými prieskumami, s tepelným preťažením.
Dôležité prejavy (hrubo rozptýlené domy)
Dôležité pevné látky prítomné v prírodných vodách sú zložené z častíc ílu, piesku, muly, suspendovaných organických a anorganických látok, planktónu a iných mikroorganizmov. Koncentrácia dôležitých častíc je spojená so sezónnymi faktormi a režimom odtoku a tvorbou snehu, pórov, zásobných lôžok a výsledkom antropogénnych faktorov, ako je vidiecke panstvo, mestská zástavba a pod.
Dôležité faktory závisia od čírosti vody a prenikania svetla do nej, od teploty, od rozkladu zložiek povrchovej vody, od adsorpcie toxických látok, ako aj od skladovania a distribúcie ložiska a od plynulosti sedimentácie. . Voda, ktorá obsahuje veľa dôležitých častíc, nie je vhodná na rekreačné pitie z dôvodu estetickej očisty.
Meranie počtu suspendovaných častíc je dôležité pri sledovaní procesov biologického a fyzikálno-chemického čistenia odpadových vôd a pri hodnotení, či sa z nich stáva voda prírodná.
Hrubo rozptýlené domy sa identifikujú gravimetrickou metódou po vystužení kašou a prefiltrovaní cez filter „modrej čiary“ (dôležité pre vzorky s otvorom menším ako 10 cm).
Organoleptické opatrenia
Spôsob určenia vodného objektu sa stane cestou môjho nerušeného pohľadu. V prípade organoleptických problémov sa osobitná pozornosť venuje predmetom, ktoré sú pre danú vodu alebo vodný tok nedôležité a často poukazujú na jeho prekážku: úhyn rýb a iných vodných organizmov, výrastky, pohľad na guľôčky plynu z usadenín na dne, vzhľad tekutosti, cudzie znečistenie, zápach, farba vody, tavenina ťažkého benzínu atď.
Vôňa
Sila vody u ľudí a tvorov je špecifická pre sliznicu nosných priechodov. Charakteristický je zápach vodydruhy pachovі intenzita zápachu. Intenzita vône vody sa mení s vodou. Zápach vody je spôsobený uvoľňovaním pachových látok, ktoré pochádzajú z vody v dôsledku životných procesov vodných organizmov, biochemického rozkladu organických látok, chemickej interakcie zložiek a blízkosti vody, ako aj priemyselné, poľnohospodárske a vládne odpadové vody.
Vôňa vody je ovplyvnená množstvom tekutín, teplotou, hodnotou pH, úrovňou nepriechodnosti vodného útvaru, biologickou situáciou, hydrologickými pomermi a pod.
|
Skorochennya |
klasifikácia zápachu |
naneste alebo naneste Mozhlive Dzherelo na vôňu |
|
A |
aromatické alebo korenisté |
gáfor, klinček, levanduľa, citrón |
|
Ae |
ogyrkovy |
Senura |
|
B |
balsamico alebo cmar |
pelargónie, kosatec, vanilka |
|
Bg |
pelargónie |
Asterionella |
|
Bn |
nasturtium |
Aphanizomaenon |
|
sladké drievko |
Coelosphaerium |
|
|
fialový |
Mallomonas |
|
|
C |
chemický |
priemyselné odpadové vody alebo chemické čistenie |
|
Z |
chlór |
voľný chlór |
|
Ch |
insacharid |
odpadové vody z ropných rafinérií |
|
Cm |
likarsky |
fenoly a jodoform |
|
D |
neprijateľný alebo silne expresívny neprijateľný |
Sirkovoden |
|
Df |
Rhybnium |
Uroglenopis a Dinobryon |
|
Dp |
hnis |
Anabaena |
|
Dз |
hnilé |
stojaté odpadové vody |
|
E |
pozemský |
sira zem |
|
G |
rašelinový |
rašelina |
|
bylinný |
bola tam tráva |
|
|
M |
zatuchnutý |
prucha slama |
|
mm |
plesnivý |
Sýrsky suterén |
|
V |
ovce |
zeleninový koreň |
Zvýšená intenzita zápachu vody
|
intenzita zápachu, skóre |
charakteristický |
vôňa |
|
0 |
žiadny zápach |
prítomnosť výrazného zápachu |
|
ja |
veľmi slabá |
zápach, ktorý si obyvateľ nevšimne, ale zaznamená ho cudzinec |
|
II |
slabý |
vôňa, ktorá sa javí ako živý človek, ako keby mal zomrieť na vašu úctu |
|
III |
vyznamenali |
zápach, ktorý sa dá ľahko zistiť, môže byť dôvodom, že voda nie je vhodná na pitie |
|
IV |
Virazny |
vôňa, ktorá priťahuje rešpekt; môžete sa unaviť z pitia |
|
V |
veľmi silný |
vôňa, nápoj je silný, takže voda je nevhodná na pitie |
Zákal
Zákal prírodných vôd je spôsobený prítomnosťou jemne rozptýlených domov, tvorených anorganickými alebo pevnými anorganickými a organickými prúdmi rôzneho pôvodu. Je nevyhnutné vykonať popis: slabá opalizácia, opalizácia, slabý, nápadný a silný kalamut.
Zákal vody sa zisťuje turbidimetricky (zoslabením svetla prechádzajúceho cez vzorku). Turbidimetrické prevedenie je určené pre vody, ktoré tvoria malý sklad a tvar jemne rozptýlených domčekov. Bez dopredného filtrovania vzorky sú turbidimetricky viditeľné nielen pevné častice, ale aj hrubo rozptýlené častice.
Farebnosť
Ukazovateľ tvrdosti vody, ktorý charakterizuje intenzitu prípravy vody a vylúhovania namiesto fermentácie; sa objavuje v stupňoch na platinovo-kobaltovej stupnici. To znamená, že vzorkovaná voda je vyrovnaná so vzorkami.
Farba prírodných vôd je spôsobená prítomnosťou humusových látok a polotrivalentnej tekutiny. Mnohé z týchto riek ležia v dôsledku geologických faktorov, vodonosných vrstiev, charakteru pôdy, prítomnosti pôdy a rašelinových nánosov v povodí atď. Na doplnenie intenzívnej prípravy vody možno využiť aj odtoky vody z rôznych podnikov.
„Správna farba“ je rozlíšená, čo znamená iba oddelené slová, a farba je „vytvorená“, vďaka prítomnosti farby a dôležitých častíc vo vode je vzťah medzi niektorými významnými význammi označený hodnotou pH.
Vysoký farebný obsah vody ničí jej organoleptické vlastnosti a negatívne ovplyvňuje vývoj vodných rastlín a živočíšnych organizmov v dôsledku prudkého poklesu koncentrácie rozpustených kyselín vo vode, ktoré sa vynakladajú na oxidáciu prieniku vody a humusových tokov.
Serendipity
Čistota (alebo priepustnosť svetla) prírodných vôd je spôsobená ich farbou a kalamutizmom atď. Namiesto toho majú rôzne pripravené a dôležité organické a minerálne látky.
Voda je uložená v štádiu čírosti a inteligentne rozdelená na číru, slabo opalescentnú, opalescentnú, trochu kalamutnaju, kalamutnaju, silne kalamutnaju. Úroveň jasnosti je výška vody, v ktorej môžete vytvoriť bielu dosku jemných veľkostí, ktorá sa spustí pri vode (Secchi disk) alebo vystrihne na bielom papieri písmo jemnej veľkosti a typu (zvyčajne stredne ťažké písmo a kučery 3,5 mm). Výsledky sú vyjadrené v centimetroch podľa uvedenej metódy merania.
Oslabenie intenzity svetla v kamennej vode s hlinou vedie k väčšej absorpcii slnečnej energie v blízkosti povrchu. Vzhľad teplej vody na povrchu mení prenos kyslosti z vetra do vody, znižuje hrúbku vody a stabilizuje stratifikáciu. Zmena svetelného toku tiež znižuje účinnosť fotosyntézy a biologickú produktivitu vody.
Dôležitosť viditeľnosti vody je povinnou súčasťou programu sledovania tvorby vodných objektov. Pre rybníky a eutrofické vody je typický nárast počtu hrubo rozptýlených domov a kalamity.
Vodneviy indikátor pH
CO2+ H20<--->H++ HCO 3 -<--->2H++ CO 3 2-
Pre jasnosť vyjadrenia bola namiesto vodných iónov zavedená hodnota, ktorá je logaritmom ich koncentrácie, braná s opačným znamienkom:
pH = - lg.
Pre povrchové vody, ktoré obsahujú malé množstvo oxidu uhličitého, je typická reakcia. Zmeny pH úzko súvisia s procesmi fotosyntézy (prostredníctvom pridávania CO2vodný rast). Vodné ióny Jerelom sú tiež humínové kyseliny prítomné v pôdach. Hydrolýza solí dôležitých kovov hrá úlohu v týchto situáciách, ak sa z vody spotrebúvajú značné množstvá síranov, hliníka, medi a iných kovov:
Fe 2++ 2H20 --> Fe(OH)2+2H+
|
Hodnoty pH v riečnych vodách kolíšu medzi 6,5-8,5, pri atmosférických zrážkach 4,6-6,1, v močiaroch 5,5-6,0, v morských vodách 7,9-8,3. Koncentrácia iónov vo vode sa mení až do sezónnych období. V zime by mala byť hodnota pH pre väčšinu riečnych vôd 6,8-7,4, prítok 7,4-8,2. pH prírodných vôd je určené geológiou povodia. |
pH vody je jedným z najdôležitejších ukazovateľov kvality vody. Koncentrácia iónov vody je dôležitá pre chemické a biologické procesy, ako v prírodných vodách. Hodnota pH určuje vývoj a vitalitu vodných burín, odolnosť voči rôznym formám migrácie prvkov, agresívne pôsobenie vody na kov a betón. pH vody ovplyvňuje aj proces premeny rôznych foriem biogénnych prvkov, čím sa mení toxicita škodlivín.
Vo vodnom útvare môžete vidieť niekoľko fáz v procese ich okysľovania:
1. V prvej fáze sa pH prakticky nemení (hydrogenuhličitanové ióny neutralizujú ióny H+). Toto sa robí dovtedy, kým hladina vody vo vodnom útvare neklesne približne 10-krát na hodnotu menšiu ako 0,1 mol/dm 3 .
2. v inom stupni okyslenia vody pH vody dlhodobo nestúpa nad 5,5. O takýchto vodných nádržiach sa dá hovoriť, akoby boli stredne kyslé. V tomto štádiu acidifikácie sa pozorujú výrazné zmeny v druhovom zložení živých organizmov.
3. v treťom stupni okysľovania pH vodou sa stabilizuje na hodnotách pH<5 (обычно рН=4.5), даже если атмосферные осадки имеют более высокие значения рН. Это связано с присутствием гумусовых веществ и соединений алюминия в водоемах и почвенном слое.
Prírodné vody na úrovni pH možno racionálne rozdeliť do tejto skupiny:
|
silne kyslá voda |
pH< 3 |
výsledok hydrolýzy solí dôležitých kovov (bane a banské vody) |
|
kyslá voda |
pH = 3...5 |
dostupnosť kyseliny uhličitej, fulvových kyselín a iných organických kyselín z rozkladu organických látok |
|
mierne kyslá voda |
pH = 5...6,5 |
prítomnosť humínových kyselín v pôde a močiarnych vodách (vody lesnej zóny) |
|
neutrálne vody |
pH = 6,5...7,5 |
prítomnosť Ca(HCO 3) 2, Mg(HCO 3) 2 vo vodách |
|
slabé vody |
pH = 7,5...8,5 |
rovnaký |
|
mláky vody |
pH = 8,5...9,5 |
prítomnosť Na2C03 alebo NaHC03 |
|
silne kaluže vody |
pH > 9,5 |
rovnaký |
Oxidový potenciál (Eh)
Svet chemickej aktivity prvkov alebo ich reakcií v cirkulujúcich chemických procesoch spojených so zmenami náboja iónov v chemikáliách. Hodnoty oxidačných potenciálov sú vyjadrené vo voltoch (milivoltoch). Oxidový potenciál akéhokoľvek cirkulačného systému sa vypočíta podľa vzorca
Eh = E 0
+ (0,0581/n) log (Ox/Červená) pri t = 20 °С
de Eh- Oxidový potenciál strednej látky;
E 0- Normálny oxidačný potenciál, s
aká koncentrácia oxidovaných a obnovených foriem činidla
medzi sebou;
Vôl- koncentrácia oxidovanej formy;
Červená- Koncentrácia aktualizovaného formulára;
n- Počet elektrónov, ktoré sa zúčastňujú procesu.
Štúdium redoxného potenciálu nám umožňuje identifikovať prirodzené médiá, v ktorých sa môžu vytvárať chemické prvky s rôznou valenciou vo forme piesne, ako aj identifikovať médiá, v ktorých je možná migrácia kovov Lv.
V prírodných vodách existuje niekoľko hlavných typov geochemických podmienok:
1. oxidačné- charakterizované hodnotami Eh > + (100 - 150) mV, prítomnosťou silnej kyseliny, ako aj celého radu prvkov v najvyššej forme ich mocenstva (Fe 3+, Mo 6+, As 5- , V5+, U6+, Sr4+, Cu2+, Pb2+);
2. prechodný oxid-báza - indikované hodnotami Eh + (100-0) mV, nestabilným geochemickým režimom a striedaním vody a kyseliny. V mysli je mierna oxidácia a slabá obnova množstva kovov;
3. Ľúbim ťa - charakterizované hodnotami Eh< 0. В подземных водах присутствуют металлы низких степеней валентности (Fe 2+ , Mn 2+ , Mo 4+ , V 4+ , U 4+), а также сероводород.
Eh a pH spolu súvisia.
Kyslosť
Kyslosť sa nazýva namiesto vody, ktorá reaguje s hydroxylovými iónmi. Hydroxid vitrátu odstraňuje kyslosť vody. Vo väčšine prírodných vôd je kyslosť väčšiny zrážok spôsobená prítomnosťou oxidu uhličitého. Prirodzenú súčasť kyslosti tvoria aj huminové a iné slabé organické kyseliny a katióny slabých zásad (amónne ióny, sliny, hliník, organické zásady). V takýchto poveternostných podmienkach nie je pH vody nikdy nižšie ako 4,5.
V nádržiach s rybníkmi sa môže z priemyselných odpadových vôd vypúšťať veľké množstvo silných kyselín a ich solí. V zime môže byť pH až 4,5. Časť kyslosti, ktorá znižuje pH na hodnoty<4.5, называется свободной.
Lužnist
Pre prírodné a čistené vody je dôležité naviazať svoje zložky na rovnakú silu ako silné kyseliny. Vlhkosť je spôsobená prítomnosťou aniónov slabých kyselín vo vode (uhličitany, hydrouhličitany, kremičitany, boritany, siričitany, hydrosulfity, sulfidy, hydrosulfidy, anióny humínových kyselín, fosforečnany) - ich súčet je tzv.zagalnoy luzhnіstyu . Vzhľadom na nevýznamnú koncentráciu troch zostávajúcich iónov určujú obsah uhličitanu vo vode iba anióny kyseliny uhličitej (obsah uhličitanu). Anióny, ktoré hydrolyzujú, vytvárajú hydroxylové ióny:
CO 3 2-+H20<--->HCO 3 -+OH-;
HCO 3 -+H20<--->H2CO3+ OH-.
Cínovosť je určená množstvom silnej kyseliny potrebnej na neutralizáciu 1 dm 3riadiť Vlhkosť väčšiny prírodných vôd je určená neprítomnosťou hydrouhličitanov vápnika a horčíka, pH týchto vôd nepresahuje 8,3.
Je dôležité venovať pozornosť pridávaniu chemických látok potrebných na úpravu vody na zásobovanie vodou, ako aj pri čistiacom čistení odpadových vôd. Dôležitosť vyššie uvedených koncentrácií kovov z trávnych porastov je dôležitá aj pri inštalácii vodovodu na zavlažovanie. Hodnota pH vody zároveň slúži na rozklad uhličitanov a vyrovnávanie kyseliny uhličitej vo vode.
Namočené nohy
Vidnošný namiesto kyslej vody, výrazy v stovkách normálnych. Skladujte pri teplote vody, atmosférickom tlaku a slanosti. Vypočítané pomocou vzorca
M = (a*101308*100)/NP ,
de M
- Stupeň nasýtenia kyslou vodou, %;
A
- Koncentrácia kyseliny, mg/dm 3 ;
R
- Atmosférický tlak na tomto mieste, Pa.
N
- Normálna koncentrácia kyseliny pri danej teplote,
mineralizácia (slanosť) a sterilný tlak 101308 Pa.
Tvrdosť
Tvrdosť vody je sila prírodnej vody, ktorá spočíva v prítomnosti hlavnej príčiny rozkladu vápenatých a horečnatých solí. Sumarny namiesto týchto solí sa nazývado očí bijúca krutosť . Zagalnaya tvrdosť je rozdelená nauhličitanv dôsledku koncentrácie hydrouhličitanov (a uhličitanov pri pH > 8,3) vápenatých a horečnatých solí,nekarbonátové- koncentrácia vápenatých a horečnatých solí silných kyselín vo vode. Z uhličitanu prechádzajú úlomky hydrokarbonátu vo vriacej vode, ktoré upadajú do obkľúčenia, uhličitanová tvrdosť je tzv.tímová hodina alebo iný unaví sa. Horkosť, ktorá sa po varení stratí, sa nazýva chudá.Výsledky výpočtu intenzity sú vyjadrené v mg-eq/dm3 .
V prírodných mineráloch vápnik, horčík a iné trávové kovy, ktoré spôsobujú tvrdosť, pochádzajú z vody v dôsledku interakcie rozpusteného oxidu uhličitého s uhličitanovými minerálmi a iných procesov ničenia a chemickej vitrifikácie horských plemien. Tieto ióny zahŕňajú mikrobiologické procesy, ktoré sa vyskytujú v pôdach v povodí, v ložiskách na dne, ako aj v odpadových vodách z rôznych priemyselných odvetví.
Je mimoriadne dôležitá (až 70%) tvrdosť, obsahujúca ióny vápnika; avšak v určitých prípadoch môže tvrdosť horčíka dosiahnuť 50-60%. Tvrdosť morskej vody a oceánskej vody je významná (desiatky a stovky mg-eq/dm 3 ). Tvrdosť povrchových vôd je nízka až do výrazných sezónnych výkyvov, najvyššiu hodnotu dosahuje koncom zimy a najnižšiu počas sezóny.
Vysoká tvrdosť vychutnáva organoleptickú silu vody, dodáva jej horkú chuť a napĺňa orgány jedom.
Oxidácia: manganistan a bichromát (GPK)
Hodnota, ktorá charakterizuje organické a minerálne látky vo vode, ktoré sú oxidované jedným z najsilnejších chemických oxidačných činidiel. Existuje množstvo druhov oxidácie vody: manganistan, bichromát, jodičnan, cér. Najvyššia úroveň oxidácie sa dosahuje metódami oxidácie vody bichrómanom a jodičnanom.
Vyjadruje sa v miligramoch kyslosti, ktorá prispieva k oxidácii organických látok, ktorá sa nachádza v 1 dm 3 riadiť
Ukladanie organických tokov v prírodných vodách je tvorené prílevom mnohých faktorov. Medzi najvýznamnejšie patria biochemické procesy čistenia a premeny vnútrozemských vodných ciest z iných vodných útvarov, z povrchového a podzemného odtoku, z atmosférického spadu, z priemyslu a štátnej správy - odpadové vody. Organické zlúčeniny, ktoré sa usadzujú vo vode a dostávajú sa do ďalšieho štádia, sa veľmi líšia svojou povahou a chemickými vlastnosťami, vrátane odolnosti voči rôznym oxidačným činidlám. Vzťah medzi vodou a ľahko oxidovateľnými látkami výrazne prispieva k oxidácii vody v mysliach tých a iných metód.
V povrchových vodách sa organické látky nachádzajú v rozloženom, dôležitom a koloidnom stave. Zvyšok rutinnej analýzy nie je striktne zaručený, čo je určené oxidáciou filtrovaných (organický odpad) a nefiltrovaných (organický odpad) vzoriek.
|
Množstvo oxidácie prírodných vôd sa pohybuje od často miligramov až po desiatky miligramov na liter v závislosti od biologickej produktivity vody, stupňa znečistenia organickými látkami a podlahy.od biogénnych prvkov, ako aj od prítoku organických tokov z prírodné zdroje, ktoré pochádzajú z pôdy, rašeliny atď. .P. . Povrchové vody majú vyššiu úroveň oxidácie v porovnaní s podzemnými vodami (desatiny miligramu na 1 dm3), čo je spôsobené vodami získanými z nafty a podzemnými vodami, ktoré sú bolestivé pre život. Rieky a jazerá Girsky sa vyznačujú oxidáciou 2-3 mg O / dm 3, rieky - 5-12 mg O / dm 3, rieky s močiarmi - desiatky miligramov na 1 dm 3. |
Oxidácia povrchových vôd bez prekážok odhaľuje jasnú fyzicko-geografickú zonalitu.
Fyziografická zonalita prírodných vôd
|
Oxidácia |
mgO/l |
Zóna |
|
Veľmi malé |
0 - 2 |
Visokogirja |
|
Mala |
2 - 5 |
Girského okresy |
|
Serednya |
5 - 10 |
Zóny listnatých lesov, stepné, opustené a opustené oblasti, ako aj tundra |
|
Presunuté |
15 - 20 |
Pivnična a pivdennaja tajga |
Oxidácia je pomalá až po bežné sezónne výkyvy. Ich charakter naznačuje na jednej strane hydrologický režim a dlhodobý tok organických riek z povodia a na druhej strane hydrobiologický režim.
Vo vodných útvaroch a vodných tokoch, ktoré sú vystavené silnému prílevu ľudskej činnosti, zostáva zmena oxidácie charakteristikou, ktorá mení režim prúdenia odpadových vôd. Pre prírodné málo znečistené vody sa odporúča použiťoxidácia manganistanu ; spravidla v bahnitejších vodách,oxidácia dvojchrómanov (BPO) .
V monitorovacích programoch sa GPC deteguje ako látka namiesto organickej hmoty vo vzorke, ktorá je náchylná na oxidáciu silnými chemickými oxidačnými činidlami. GPC sa používa na charakterizáciu vodných tokov a vodných útvarov, zásobovanie odpadovými vodami a priemyselnými odpadovými vodami (vrátane stupňa ich čistenia), ako aj povrchový odtok.
Na výpočet koncentrácie uhlíka prítomného v organických látkach sa hodnota GPC (mg/dm3) vynásobí 0,375 (koeficient, ktorý sa rovná množstvu uhlíka ekvivalentnému množstvu uhlíka) ekvivalentnému kisnu).
Biochemická kyslosť (BOD)
Stupeň kontaminácie vody organickými zlúčeninami sa označuje ako kyslá kyslosť, ktorá si vyžaduje ich oxidáciu mikroorganizmami v aeróbnych drenážoch. Biochemická oxidácia rôznych látok prebieha s rôznou likviditou. K ľahko oxidovateľným („biologicky mäkkým“) látkam sa pridávajú formaldehyd, nižšie alifatické alkoholy, fenol, furfural atď. , neiónové PAR a in.
BOD 5
V laboratórnych mysliach je objednávka od BSK.označené ako BSK 5- biochemická požiadavka na kyslé za 5 rubľov.
Sezónne zmeny spočívajú najmä v zmenách teploty a výstupnej koncentrácie rozpustenej kyseliny. Infúzia teploty je indikovaná jej infúziou do plynulosti fermentačného procesu, ktorá sa zvýši 2-3 krát pri zvýšení teploty o 10 o C. Infúzia koncentrácie klasu kyseliny do procesu biochemickej fermentácie kyseliny. je známe, že významná časť mikroorganizmov má svoje kyslé optimum pre halal vývoj pre fyziologickú a biochemickú aktivitu.
Dodatočný výpočet hodnôt BSK 5zostávajú aj vo výstupnej koncentrácii rozpustenej kyseliny, ktorá sa dá ľahko zmeniť na 2,5 mg/dm3Je dôležité mať na pamäti intenzitu procesov jeho výroby a rastu. Význam zmien hodnôt BSK 5v hĺbke štádia obštrukcie vody.
Hodnota BSK 5vo vodných útvaroch s rôznym stupňom obštrukcie .
|
Preplnené schody (trieda s vodou) |
BOD 5 |
|
Veľmi čisté |
0.5 - 1.0 |
|
Čistý |
1.1 - 1.9 |
|
Pokojne upchatý |
2.0 - 2.9 |
|
Preplnené |
3.0 - 3.9 |
|
Brudni |
4.0 - 10.0 |
|
Viac ako neslušné |
> 10.0 |
Pre vodné nádrže kontaminované najmä odpadovými vodami Gospodarsko-butovye, BSK 5priblížiť sa k 70 % BSK pvn. .
Vaznachennya BSK 5v povrchových vodách sa používa ako metóda hodnotenia namiesto biochemicky oxidovaných organických látok, prítomnosti hydrobiontov a ako integrálny indikátor obštrukcie vody. Je potrebné skontrolovať hodnotu BSK 5pod hodinou sledovania účinnosti práce čistenia spór.
BOD p.v.
Zvýšená biochemická kyslosť (BSK) je dôležitá pre kyslosť kyslosti, ktorá si vyžaduje oxidáciu organických zlúčenín, aby sa začal proces nitrifikácie. Na oxidáciu amónneho dusíka na dusitany a dusičnany sa používa veľa kyseliny, aby sa nespotrebovala BSK.
Pre komunálne odpadové vody (bez odpadových vôd z priemyslu odpadových vôd) vypočítajte BSK 20, čo je veľmi blízke BSK.
MINISTERSTVO ENERGIE A ELEKTROTECHNIKY SRSR
VEDÚCI VEDECKO-TECHNICKÉHO RIADENIA ENERGETIKA A ELEKTROTECHNIKY
METODIKA VIKONANNYA VIMIRYUVAN
VYSOKÁ ELEKTRICKÁ VODIVOSŤ
VODA A PÁR ENERGETICKÝCH ZARIADENÍ TEC
AUTOMATICKÝ KONDUKTOMETER
Technika zabezpečí získavanie spoľahlivých údajov o presnosti meraní v stacionárnom prevádzkovom režime dodávky energie.
Metodika je priamočiara pre stagnáciu na TPP, ako aj pre projekčné a ťažobné organizácie.
1. ASSOBI VIMIRYUVAN A DOPLNKOVÉ
PRÍLOHA
1.1. Pri vicinácii UEP je inštalovaný súbor metód pre vibračné a prídavné zariadenia, ktoré zabezpečujú výber a prípravu vzorky pred vimirvanáciou a extrakciu informácií o UEP vzorky. Zoznam potrebných funkcií pre inštaláciu a pomocné zariadenia, ich charakteristiky a technické charakteristiky sú uvedené v prílohe 1.
Je povolené používať iné metódy tlmenia bez ohrozenia odporúčaných technických a metrologických charakteristík.
1.2. Odber vzoriek vody a pary za účelom vibračného UEP sa vykonáva pomocou odberových zariadení OST 108.030.040-80 "Zariadenie na odber vzoriek pary a vody zo stacionárnych parných kotlov. Typy, prevedenie, rozmery a technické špecifikácie a super."
Preprava vzoriek prebieha za zapečatenými linkami na odber vzoriek, ktoré sú v súlade s OST 108.030.04-80.
1.3. Štrukturálny diagram vimiryuvan UEP sa prinesie dieťaťu.
Štrukturálny diagram vimirov UEP:
a – kondenzát; b - živá (kotlová) voda;
c - infúzna a prehriata para;
1 - zariadenie na odber vzoriek; 2 - pohyb
chladnička; 3 – systém prípravy vzoriek;
4 – automatický merač vodivosti;
5 - linka na odber vzoriek
Keď je nainštalované výpočtové zariadenie na zber a spracovanie výsledkov stmievania UEP, výstupný signál merača vodivosti sa prenáša do informačno-výpočtového komplexu.
2. METÓDA VIMIRYUBANNA
Vibrácie UEP sa sledujú metódou kontaktnej konduktometrie, ktorá je založená na dôkaze prenosu elektrických nábojov iónmi rozbitých látok pri prechode prúdu analýzou rozbitých látok.
3. BEZPEČNOSŤ VIMOGI
V prípade zániku UEP je potrebné dodržiavať „Pravidlá bezpečnostných zariadení pri prevádzke termomechanických zariadení elektrární a tepelných opatrení“ (M.: Energoatomizdat, 1985).
4. VIMOGS A KVALIFIKÁCIA OPERÁTOROV
Jednotlivci, ktorí prešli špeciálnym školením a môžu byť kvalifikovaní, môžu mať povolenie spracovať výsledky a spracovať výsledky:
pri servise je vimiruvan elektrická jednotka nie nižšej ako 3. kategórie, ktorá pozná konštrukčné, inštalačné a elektrické obvody vimiruvantu UEP, konštrukciu a princíp činnosti zariadení vimiruvantu, ktorý musí byť stagnovaný a testovanie vzorky, prvé zariadenia, vzorkovacie linky;
Pri spracovaní výsledkov simulácií pozná technik alebo inžinier špecifiká vodno-chemického režimu elektrárne.
5. UMOVI VIKONANNYA VIMIRYUVAN
prítomnosť iných spoľahlivých značiek na schopnosť vymrieť.
6.2. Príprava na prevádzku vibračných funkcií sa musí vykonať v súlade s pokynmi uvedenými v návode na obsluhu.
6.3. Príprava pred prevádzkou N-katexového filtra sa vykonáva podľa metodiky uvedenej v "Metodickom návode na stanovenie konduktometrickej kontroly na udržiavanie vodného režimu elektrární. MU 34-70-114-85" (M.: SPO " Sojuztechenergo", 1986).
7. WYKONANNY VIMIRYUVAN
7.1. Pri víťazstve je vimiryuvan UEP potrebný:
udržiavať normálny prevádzkový režim systému na prípravu vzorky vrátane monitorovania a v prípade potreby úpravy prietoku vzorky do meradla vodivosti;
pravidelne kontrolovať správnosť odčítania merača vodivosti a v prípade potreby vykonať jeho úpravu;
okamžite regenerujte H-katiónový filter;
Pravidelne čistite primárny rekonštituovaný roztok.
7.2. Ak chcete overiť správnosť údajov merača vodivosti, skontrolujte výsledky a porovnajte ich s laboratórnym meračom vodivosti.
7.3. Kontrola správnosti údajov merača vodivosti, čistenie primárneho filtra a regenerácia N-katexového filtra sa vykonáva v intervaloch uvedených v „Regulačnom materiáli pre prevádzku a opravu automatických chemických kontrolných zariadení AK-31“ 0 ta pH- 201. NR 34-70-009-.: SPO "Soyuztekhenergo", 1982).
7.4. Regenerácia N-katexového filtra, ktorý bol počas prevádzky vyradený, ako aj čistenie kontaminovaného primárneho reaktora sa vykonáva výhradne na vložkách, ktoré sú umiestnené v „Metodických vložkách“ pred konduktometrickou kontrolou pre vedenie nya vodný režim elektrární. MU 34-70-114-85"
8. PRODUKCIA A FORMULÁCIA VÝSLEDKOV
VIMIRYUVAN
8.1. Výsledky vimiruvanu UEP sa musia upraviť na teplotu vzorky 25 °C. V týchto prípadoch, ak máte denné zariadenie na automatické hlásenie výsledkov pri teplote 25 °C, je potrebné výsledky zobraziť manuálne pomocou grafov. Čo obsahuje "Metodický návod na ustanovenie konduktometrickej kontroly na udržiavanie vodného režimu elektrární. MU 34-70-114-85".
8.2. Ako indikátor presnosti kalibrácie UEP sa berie interval, ktorý je spoľahlivý R d Dochádza k totálnej porážke vyhynutia.
Výsledky výhier UEP a stávok sú uvedené v nasledujúcej forme:
de - výsledok vimiru UEP, µS/cm;
Povolené hodnoty absolútnej straty extinkcie, µS/cm;
R d- spoľahlivosť, vďaka ktorej na určitých hraniciach dochádza k deštrukcii vimiru UEP.
8.3. Číselné hodnoty výsledku smrti a krádeže môžu skončiť číslami rovnakého rádu.
V prípade smrti má číselná hodnota výsledku smrti a únosu vinnej matky dve významné čísla.
8.4. Medzi hodnotami celkovej absolútnej krádeže vimiryuvanu ( D) UEP v zagalnom tvare je označený vzorcom:
 (2)
(2)
de D spp- absolútna strata vimizácie spôsobená zmenou fyzikálno-chemických autorít analyzovanej vzorky, keď prechádza rôznymi prvkami selekčného systému, keď prechádza rôznymi prvkami prípravy vzorky selekčného systému, µS/cm;
D AK- Absolútna strata meradla vodivosti, µS/cm;
Dxja -ďalší únos spôsobený vykorisťovaním i- individuálny vimiryuvan, ktorý je zahrnutý pred schémou vimiryuvan UEP, ako je normálny, µS/cm;
n- Počet zmierňujúcich prvkov, ktoré sú zahrnuté pred schémou zmierňovania UEP.
Medzi prípustnou hodnotou celkovej absolútnej straty zániku UEP pre normálne myslenie využívania prostriedkov zániku ( DO) je označený vzorcom:
![]() (3)
(3)
Význam dodatočných škôd spôsobených prevádzkou funkcií vyhynutia od normálnych (napríklad teplota média, životný stres a iné vonkajšie faktory uvedené v technickej dokumentácii pre Sobi vimiryuvan, scho vikoristovuyutsya) uskutočnené v nadchádzajúcom poradí :
Množstvo kožnej hodnoty M, ktoré sa podáva infúziou, sa vypočíta matematicky pomocou vzorca
de Yi- hodnota prílevu magnitúdy, odobratá o i- m vimiri;
Predtým- množstvo variácií v príleve hodnôt počas intervalu priemerovania.
Matematická hodnota hodnoty kožnej tekutiny je vypočítaná pre letnú a zimnú sezónu;
Hodnoty dodatočných strát podľa údajov vedeckej a technickej dokumentácie sú určené za účelom zániku, ktorý bude stagnovať a odpočítame sezónne hodnoty matematického výpočtu hodnoty kožnej tekutiny.
Butt rozrahunku pohibki vimiryuvan UEP nasmerovaný na dodatok 2.
8.5. Táto metóda zabezpečí odstránenie výsledkov zániku vody UEP a stávok v rámci prípustnej hodnoty vyvolanej straty zániku ± 5% s dôverou v presnosť R d = 0,95.
Dodatok 1
VIMIRYUVAN ESTATES A POMOCNÉ ZARIADENIA PRE JEHO FUNKCIE
I TECHNICKÉ CHARAKTERISTIKY
|
názov |
Hlavné technické a metrologické charakteristiky |
Pridelenie |
|
Zariadenie na odber vzoriek |
Výber vzorky |
|
|
Linka na odber vzoriek |
Materiál - nehrdzavejúca oceľ 12Х18Н12Т, priemer 10×2 mm, montáž vhodná pre OST 108.030.04-80 |
Privádzanie vzorky zo zariadenia na odber vzoriek do primárneho vibračného meniča meradla vodivosti |
|
Mobilná chladnička |
Zaslané na OST 108.030.04-80 |
Chladenie vzoriek živej vody, kotlovej vody, pary |
|
Systém prípravy vzoriek (SPP, SUPP) |
Obsahujte vzorky v množstve 0,008 až 0,028 kg/s (pri 30 až 100 l/rok). Skúšobný tlak na vstupe 1 až 30 MPa; tlaková skúška na výstupe (0,1? 0,005) MPa. Teplota vzorky na výstupe nie je vyššia ako (40? 1) °C |
Zjednotenie parametrov vzorky (tlak, teplota); alarm o prekročení prípustných hodnôt teploty a tlaku vzorky a o pripojení prívodu vzorky; na ochranu prvkov pred vibráciami, aby vzorkovali vysoké parametre. |
|
Automatický merač vodivosti AK-310 |
Rozsah zobrazenia: 0 až 1; typ 0 až 10; 0 až 100 µS/div. Hlavné zníženie je ± 5% horného rozsahu indikácie. Vitrata probi (5,6+0,3)?10 -3 kg/s ((20±1) l/rok) |
Vibrácia a registrácia vzorky UEP |
Dodatok 2
Dovidkov
BUTT ROZRAKHUNKU MOŽNOSŤ VIMIRYUVAN UEP
MIMO ÚDAJE TECHNICKEJ DOKUMENTÁCIE
1. Vimiryuvannya UEP pre normálne mysle využívania schopností vimiryuvanniya.
Predpokladajme, že hodnota celkovej absolútnej straty zániku VŠE pre normálne myslenie využívania zánikových právomocí je určená vzorcom (3).
Právne podrobnosti:
vhodné pre zariadenie na odber vzoriek a linku na odber vzoriek až do OST 108.030.04-80;
systém prípravy vzoriek – typ SUPP;
Teplota UEP sa zisťuje automatickým meračom vodivosti AK-310 v rozsahu 0 až 1 µS/cm.
Významné únosy vimírov UEP.
Fragmenty všetkých mozgov trivavalovej vzorky Vikonani sa dajú odobrať s dostatočnou presnosťou pre prax Dspp = 0.
S výhradou odseku 5 dodatku 1 DAK- 0,05 μsm/cm.
Celková strata vimiryuvanu sa vypočíta pomocou vzorca (3):
2. Zánik UEP s rozvojom myslí a využívaním právomocí zániku z normálnych.
Predpokladajme, že hodnota celkovej absolútnej straty zánikom UEP je určená vzorcom (2).
Právne podrobnosti:
Podmienky umývania UEP sú rovnaké ako v prednom zadku, s jednou funkciou - stredný obrat inštalácií meračov vodivosti v miestnosti s teplotou 35 °C.
Významné únosy vimírov UEP:
D spp=0 і D AK=± 0,05 uS/cm (oddelený predný zadok);
dodatočný únos, vyklikan na reguláciu teploty prebytočného vzduchu v mieste inštalácie meniča ako normálne, s pasom pre automatický merač vodivosti AK-310, sklad DT= ± 0,025 uS/div.
Celkové vyhubenie vimirov sa vypočíta pomocou nasledujúceho vzorca (2).