Sirkhovenský sirchisny plyn. otrimannya sirkovodnyu
HODNOTA
sirvodden Je to bezbariérový plyn s charakteristickým zápachom zhnitej fľaše.
Pre počasie je veľmi dôležité stúpať pri teplotách -60,3 o С a silnejšie pri -85,6 o С.
2H2S + 302 = 2H20 + 2S02.
Ak do polovice vody vnesiete nejaký studený predmet, napríklad porcelánovú šálku, tak sa teplota o polovicu výrazne zníži a voda sa zoxiduje len do trocha šedej, potom sa usadí na miske v pohľade na sladkú vodu:
2H2S + 02 = 2H20 + 2S.
Sirevodn sa ľahko zapáli; súčet joga s prelomom dňa. Sirvodden je ešte otruynejší. Trivale zithannya povitrya, ako sa pomstiť na celý plyn navit v malom množstve, wiklikє dôležité otruunnya.
Pri 20 o S jedným objemom vody, objem 2,5 ossyagu sirvodnya. Rozchin sirvodnu pri vode sa vola s vodou... Pri státí na zákrutách, najmä na svetlách, sirkovodneva vodiČoskoro z nich budú vychádzať sirény. Tse vіdbuvaєtsya v dôsledku oxidovanej vody kyslej vody.
otrimannya sirkovodnyu
pri vysoká teplota sirka vzaєmodin s vodnem, fixačný plyn sirvodin.
Prakticky sa voda môže použiť na rozpustenie dvoch riedení kyselín na suchom kove, napríklad na sulfidovej soli:
FeS + 2HCl = FeCl2 + H2S.
Čistejšiu vodu je možné získať hydrolýzou CaS, BaS alebo A1 2 S 3. Čistejší plyn sa získava priamou reakciou vody a vody pri 600°C.
Chémia moci
Rozchin sіrvodnuyu vіdі mak vіdlivostі kyselina. Sirwater je slabá dvojsýtna kyselina. Vona disociačná fáza často a hlavne v prvej fáze:
H2S↔H+ + HS- (Ki = 6 x 10-8).
Disociácia na inej úrovni
HS - ↔H++ S2- (K2 = 10-14)
pult v malom svete.
Sirevodn je silným lídrom. Keď sa silné oxidačné vína oxidujú na oxid siričitý alebo na kyselinu sírovú; oxidovaný glybín, ktorý sa má ukladať podľa typu odtoku: teplota, rozsah pH, koncentrácia oxidačného činidla. Napríklad reakcia s chlórom je reakciou na vývoj kyseliny chlorovodíkovej:
H2S + 4CI2 + 4H20 = H2S04 + 8HCl.
Stredné soli sa nazývajú sulfidy.
zasosuvannya sirkovodnya
Zastosuvannya sirkovodnyu dosit je zmiešaný, no, v prvom rade je spojený s vysokou toxicitou. Získanie vedomostí o depozícii v laboratórnej praxi ako odlučovača dôležitých kovov. Slúži ako syruvina na odstránenie kyseliny syruchovej, vody v elementárnom viglyade a sulfidive
Nastavte úlohy
DODATOK 1
| zavdannya | Uistite sa, že máte pre H 2 S trochu dôležitejšiu vodu. |
| rozhodnutie | Zmena hmotnosti plynu na hmotnosť plynu odoberaného v tej istej sústave, pri rovnakej teplote a rovnakom zlozvyku, sa nazýva prípustná sila prvého plynu po druhom. Hodnota zobrazenia je daná, v prípade prvého vyvinutého plynu je dôležitejší alebo ľahší ako druhý plyn. Prijateľná molekulová hmotnosť je prijatá najmenej 29 (s urahuvannya zmestu vo vіtri dusíka, kyslých a iných plynov). Slide znamená, že pochopenie „obdivuhodnej molekulovej hmotnosti jedla“ si na to mentálne zvykne, rovnako ako dobré správy. D vzduch (H2S) = Mr (H2S) / Mr (vzduch); D vzduch (H2S) = 34/29 = 1,17. Mr (H2S) = 2 x Ar (H) + Ar (S) = 2 x 1 + 32 = 2 + 32 = 34. |
| vidpovid | Siréna H 2 S je dôležitá pre obrat 1,17 krát. |
DODATOK 2
| zavdannya | Poznať odbornosť vodného toku plynov, v ktorom objem časti tvorí voda 20%, voda - 40%, voda je 40%, voda je voda H 2 S. |
| rozhodnutie | Niektoré časti plynu budú rozptýlené s molárom, tobto s časťami počtu riek, cenou dedičstva zo zákona Avogadro. Viem, vymažem molekulovú hmotnosť súčtu: M r podmienené (zmes) = φ (0 2) × M r (0 2) + φ (H 2) × M r (H 2) + φ (H 2 S) × M r (H 2 S); |
| Pomenovanie parametra | hodnotu |
| Predmet clanku: | sirvodden |
| Kategória (tematická kategória) | Kov a zváranie |
otrimannya sіrki
Veselé úrady sirki
Pri izbovej teplote vstupuje voda do reakcie iba s ortuťou. S úpravou teploty sa aktivita výrazne zvýši. Pri ohreve vody reaguje bez stredu s jednoduchými frázami, za vinu іn ertnyh plynov, dusík͵ sil en, teluru, zlato platina, іridіyu a jód. Sulfidický dusík a zlato sa odstraňujú nepriamou cestou.
- Spojenie s kovmi
syrka show oxidácia sily, V dôsledku interakcie sa vytvárajú sulfidy:
- Vzaєmodia s vodou bežať pri 150-200 ° С:
H2 + S = H2S.
- Vzaєmodiya z kisnem
Voda horí v kyseline pri 280 ° C, striedavo pri 360 ° C, pri ktorej je nastavený súčet oxidov:
S + 02 = S02;
2S + 302 = 2S03.
- Kombinácia s fosforom a uhlím
Pri zahrievaní bez prístupu k energii reaguje voda s fosforom, uhlíkom a prejavuje oxidačnú silu:
2P + 3S = P2S3;
- Kombinácia s fluórom
V prítomnosti silných oxidačných činidiel sa prejavuje nasledujúca sila:
S + 3F2 = SF6.
- vzaєmodiya zі skladanie slov
Pri prepojení so skladacími slovami syrky je to ako vodítko:
S + 2HN03 = 2NO + H2S04.
- reakčná disproporcia
Syrka je dobrá na neprimerané reakcie, keď sa vytvorí interakcia s lúkou, sulfidy a sírany:
3S + 6KOH = K2S +403 + 2K2S-2 + 3H20.
- Pôvodné rudy
- Pri ohrievaní bez prístupu k jedlu
FeS2 = FeS + S.
- Oxidácia vody v prípade nedostatku kyslosti
2H2S + 02 = 2S + 2H20.
- Z plynu vstupuje do hutníckych a koksovacích pecí, keď sa zahrieva v prítomnosti katalyzátora
H2S + S02 = 2H20 + 3S.
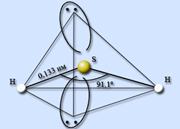
Vodneve z'adn ennya sirki - sirwater H2S ... Sirevodn je kovalentn z'єdn ennya. Molekuly sú analogické molekulám vody, atóm vody sa nachádza v štádiu sp 3-hybridizácie, ale molekuly vody molekuly vody neprijímajú. Atóm sirki mensh elektronegatívne, nіzh atóm sisnyu, maє väčšia veľkosťі, ako dedičstvo, znižujem silu náboja. HSH valenčný rez je 91,1° a H-S pásmo je 0,133 nm.
Sirevodn je svedkom a vidi. Klasifikácia a osobitosti kategórie "Sirvoden" rock 2014, 2015.
Bilančné zásoby cich komponentov sú skladované na poli v hraniciach plynu, plynového kondenzátu, plyno-naftových vetiev, ako napr.: - skladovať zásoby plynu v zásobe nie menej ako 10 miliárd m3; - zásoby cich komponentov v percentuálnom pomere sa nestanú ...
Otruennya neidentifikovaný ridin Vzhivannya pomilkovo abo namisno v nadії, scho etylovy (kharchovoy) alkohol alebo voda, nie je možné produkovať rіdin na vyprážanie organizmu. Znaky takéhoto strihu: b_l v šantení, lenivec, ...
Malý. 2.4. Viparník Obr. 2.3. Desorbér Obr. 2.2. Absorbér Obr. 2.5. Výmenník tepla "potrubie v potrubí" Metóda nízkoteplotnej separácie sa široko používa na: odvlhčovanie plynu; vizualizácia kondenzátu z plynu z tvorby kondenzátu plynu ...
GASU Až ošúchaný transport. DREVO NA ČISTENIE A PRÍPRAVU KAPITOLA 1 Obr. 2.Izolácia hlavného potrubia Zemný plyn, odkiaľ prichádza z vrcholov, aby sa pomstili pevné častice (piesok, vodný kameň), kondenzát ...
Veselé úrady Fyzická sila S extravagantnými myšlienkami je sirvodden plyn bez plynu so silným charakteristickým zápachom po skazených vajciach. Tm = -86 ° С, bp = -60 ° С, vo vode je úplne nejasné, pri 20 ° С sa v 100 g vody vypustí 2,58 ml H2S. Duzhe otruyny, s inhalačným wiklikє ...
Molekula sirvodnyu Sirvodn je non-stodolný plyn s vôňou skazených vajec. Je dobré pracovať vo vode (pri 20 ° C v 1 objeme vody je to 2,5 objemu vody). Voda môže byť odmietnutá bez priemerného času vody s vodou pri zahriatí, alebo to môžete nazvať ...
Veselé úrady
Fyzická sila
S extravagantnými myšlienkami je sirvodden plyn bez plynu so silným charakteristickým zápachom po skazených vajciach. T pl = -86 °C, T bal = -60°C, zhnitý vo vode, pri 20°C sa v 100g vody rozpustí 2,58 ml H 2S. fatálny výsledok... V prírode človek vidí v skladoch sopečných plynov, usadzuje sa v trstinách rastúcich a živých organizmov. Dobrý roztok vo vode, pri vypracovávaní zafixujem slabú kyselinu chlorovodíkovú.
- V vodný roztok voda je slabá v sile slabej dvojsýtnej kyseliny:
H2S = HS- + H+;
HS- = S2 + H+.
- Sire voda na horenie v povitri blakitnym polom. V prípade prepojeného prístupu je zriadený platný certifikát:
2H2S + 02 = 2H20 + 2S.
Pri obrovskom prístupe do ohniska ohniska by sa voda mala vyrábať pred schválením oxidu oleja (IV):
2H2S + 302 = 2H20 + 2S02.
- Sirkhoven je schopný dodať silu. Vodné usadeniny môžu byť oxidované vo vodnom roztoku na suchú vodu, čistý plyn a kyselinu sírovú.
Napríklad in vitro brómová voda:
H2S + Br2 = 2HBr + S.
výmena s chlórovou vodou:
H2S + 4CI2 + 4H20 = H2S04 + 8HCl.
Prúd vody môže byť vypálený, vikorista a oxid olovnatý, takže reakcia super vody môže viesť k veľkým druhom tepla:
3Pb02 + 4H2S = 3PbS + S02 + 4H20.
- Vzaєmodia sіrvodnyu sіrchistim plyn vikoristovuyutsya na odstraňovanie sirki z plynov, vstup do metalurgickej a sirchanovej virobniztva:
S02 + 2H2S = 3S + 2H20.
Proces zsim viazal iluminaciu prirodzenej sirky pri sopecnych procesoch.
- S hodinovým prietokom čistého plynu a vody cez lúku sa nastaví tiosíran:
4S02 + 2H2S + 6NaOH = 3Na2S203 + 5H20.
- Reakcia zriedenej kyseliny chlorovodíkovej so sulfidom zaliz (II).
FeS + 2HCl = FeCl2 + H2S
- Interakcia sulfidu hlinitého so studenou vodou
Al2S3 + 6H20 = 2Al (OH)3 + 3H2S
- Priama syntéza prvkov aby ste zistili, či v období roztopenia chýba voda:
H2 + S = H2S.
- Zahrievanie súčet parafínu s sirkoy.
1.9. Kyselina chlorovodíková a soli
kyselina chlorovodíková priťahuje všetku silu slabých kyselín. Vona reaguje s kovmi, oxidmi kovov, potravinami.
Yak je dvojsýtny, kyselina rekonštituuje dva typy solí - sulfid a hydrosulfid ... Hydrosulfidy sú dobré pre vodu, sulfidy dažďových a zemných kovov, ako aj sulfidy dôležitých kovov sú prakticky nedeštruktívne.
Sulfidy železných a neželezných kovov nie sú predvarené, sulfid môže byť charakteristický pre bary, napr. sulfid medi (II), nikel a olovo - čierna, kadmium, india, cín - zhovt, surmi - pomaranč.
Iónové sulfidy kovu M 2 S môžu mať štruktúru typu fluoritu, dermálny atóm výboja je kocka s 8 atómami kovu a dermálny atóm kovu je štvorsten so 4 atómami syrky. Sulfidový typ MS je charakteristický pre kovy lenivých zemín a môže mať štruktúru ako chlorid sodný, dermálny atóm kovu a iné s oktaédrom z atómov prvého stupňa. So silnejším kovalentným charakterom je väzba kov-syr realizovaná v štruktúrach s nižšími koordinačnými číslami.
Sulfidy kovov hrubého čreva vznikajú v prírode ako minerály a rudy, slúžia ako syruvina na odstraňovanie kovov.







