Fluór závisí od sily oxidačného činidla. oxidačná sila
HODNOTA
fluór- prvok, ktorý je možné aplikovať na skupinu halogénov. Rotácia v inom období pidskupiny VII skupiny A. Označenie - F.
Fluór je nekovový. Naybilsh elektronegatívny prvok. V zlých mysliach je fluór plyn kvitnúcej farby. Otruyniy.
V malých koncentráciách je zápach fluóru nepríjemný ako zápach ozónu a chlóru je jedna hodina.
Molekula fluóru diatomická F 2. Volodya má najnižšiu polarizovateľnosť stredných halogénov. Teplota topenia fluóru je abnormálne nízka. Nie je prístupný vode, takže ho možno skladovať (2F 2 + 2H 2 O = 4HF + O 2).
Stupeň oxidácie fluóru
Fluór prevádza diatomické molekuly do skladu F 2 na indukciu kovalentných nepolárnych väzieb a, ako sa zdá, v stranách s nepolárnymi väzbami krokov oxidovaných prvkov na ceste nula.
charakterizuje sa fluór najväčšie hodnoty elektronegativita, v ich dátach sú vždy negatívne kroky oxidovanej cesty (-1) (HF -1, OF -1 2, NaF -1 atď.).
Nastaviť úlohy
DODATOK 1
| zavdannya | V nitride dusík vykazuje oxidačné kroky -3. Uchovávajte vzorce pre nitrid lítia, nitridovú tyčinku a nitrid kremíka. |
| Rozhodnutie | Zdá sa, že lítium v oxidačných krokoch (+1). Aby ste vzorec dali dohromady, zapíšte si hodnotu chemické prvky a tiež stupeň oxidácie: Podľa analogického poradia skladu formulovali nitridovú tyčinku a nitrid kremíka. Zápach bude matkou ofenzívnej viglyády: Ba 2 N 3 a Si 3 N 4. |
| vidpovid | Li 3 N, Ba 2 N 3 a Si 3 N 4. |
DODATOK 2
| zavdannya | Karbidy v uhlíku vykazujú oxidačné kroky -4. Uchovávajte vzorce pre karbidy vápnika a hliníka. |
| Rozhodnutie | Zdá sa, že vápnik a hliník sú zrejme oxidovanými stupňami (+2) a (+3). Pre tieto chemické prvky je typický počet oxidačných krokov. Na použitie vzorca je možné zapísať zodpovedajúce chemické prvky a tiež stupne oxidácie: Vieme, že najmenej miesta (znak „-“ alebo „+“ nie je vrahovuєmo): Rozdіlimo sa odpočíta z hodnoty oxidačného kroku a čísla sa zapíšu do indexov, takže do úložiska molekúl sa pridá niekoľko atómov prvku kože: |
| vidpovid | CaC 2 a Al 4 C 3. |
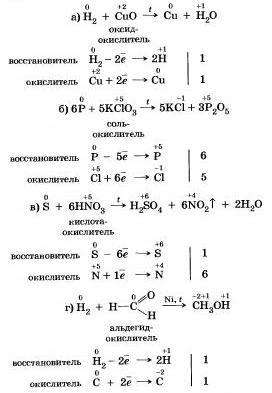
Reakcie vedúce k oxidácii (OVR)- množstvo chemických reakcií, pri ktorých dochádza k prenosu elektrónov z niektorých častíc (atómov, molekúl, iónov) na ostatné, v dôsledku čoho sa menia kroky oxidovaných atómov, ktoré vstupujú do skladu častíc častíc .
Vzhľad atómov, v ktorých sa v priebehu reakcie menia oxidačné kroky, je charakteristickým znakom OVR.
perebig chemické reakcie ako celok sa preleje výmenou malých častí a reaguje slovami. Výmena supervízorov sa často uskutočňuje prechodom elektrónov z jedného kusa na druhý. Takže s vitamínmi zinku v médiu vo forme síranu stredného (II)
Zn (t) + CuSO 4 (p) = ZnSO 4 (p) + Cu (t)
elektróny z atómov zinku prechádzajú na ióny:
Zn (t) = Zn 2+ (p) + 2 e,
Cu 2+ (p) + 2 e= Cu (t),
Súhrnne: Zn (t) + Cu 2+ (p) = Zn 2+ (p) + Cu (t).
Proces používania elektroniky sa často nazýva zoxidované a proces používania elektronických zariadení - aktualizácie... Oxidácia a obnova sa vykonávajú naraz, takže v spojení s prechodom elektrónov z niektorých častíc na tie, ktoré nazývajú reakcie vedúce k oxidácii.
Popíšem oxidačne dôležité reakcie kvôli viditeľnosti. oxidačný stupeň (n)- formálny náboj, ktorý možno pripísať atómu, ktorý môže vstúpiť pred sklad akejkoľvek časti (molekuly, iónu), pokiaľ ide o čisto iónovú povahu spojenia v danej častici (časť je zložená z ionizovaného atómy). Ako pamäť klesá, hodnota n sa neotáča v príveskoch, ale v počte dostupných (prijatých) elektronických zariadení. Náboj jedného elektronického zariadenia je -1,60218 · 10 -19 Cl.
Príliš veľa oxidačno-redukčných reakcií dohliada na zmenu stupňov oxidácie prvkov, aby sa zúčastnili reakcie reči . Pri obnovení sa menia kroky oxidovaného prvku, keď sa oxidujú - menia sa . Rechovina, pred skladom, ktorý obsahuje prvok, ktorý znižuje kroky oxidácie, volám oxidovať, Rechovina, pred skladom, ktorý obsahuje prvok, ktorý pohybuje krokmi oxidácie, volám vinník.
Oxidačný krok Prvok v danej forme začína podľa nasledujúcich pravidiel:
1. štádium oxidovaného prvku v jednoduchej reči je nulové;
2. algebraický súčet všetkých stupňov oxidácie atómov v molekulách na nulu;
3. algebraický súčet všetkých stupňov oxidovaných atómov v skladacom ióne, ako aj stupňov oxidovaného prvku v jednoduchom monoatomickom iónovom predpätí iónu;
4. negatívne kroky oxidácie sa objavujú na pozadí atómu prvku, ktorý je menej elektricky negatívny;
5. Maximálny možný (pozitívny) krok oxidácie prvku zodpovedá číslu skupiny, v ktorej je prvok odstránený v periodickej tabuľke D.I. Mendeleva.
6. V prípade jediného a kovalentne polárneho spojenia existuje viac elektricky negatívnych atómov vo forme nižších oxidačných stupňov.
7. V binárnych súboroch sú nekovové atómy spravidla najmenšími stupňami oxidácie
8. Kaluže z kovu (+1), kov hlavná skupina Skupina II (+2)
9. Keď je zvýraznená úroveň oxidácie, zmena sa zobrazí ako prvok, ktorý je zobrazený v tabuľke. Napríklad v CaO 2: n (Ca) = +2, n (O) = - 1
10. kroky oxidovaného okysľovania na polovičných cestách -2 pre vinetu peroxidu (-1) a kyslého fluoridu OF 2 (+2).
11. voda ukazuje oxidačné kroky +1 vo všetkých systémoch, okrem hydridov kovov (NaH, CaH 2 atď.), kroky oxidovaných vozoviek -1;
Na konci fáz oxidácie sa objavuje niekoľko prvkov v pozadí, ale v prítomnosti stupňov oxidácie prvkov je to zlomyseľné:
1) fluór, ktorý sa nachádza uprostred elektronegatívnych prvkov, na všetkých úrovniach oxidácie -1;
2) voda v studniach oxidačných stupňov +1, okrem hydridov kovov (-1);
3) hodil IA p_dgruppi po celú dobu oxidácie +1; 4) kovová skupina IIA, ako aj zinok a kadmium môžu mať vo všetkých prípadoch oxidačné kroky +2;
4) kroky oxidácie hliníkom v rozsahu +3;
5) kroky oxidácie kyslosti na polovičných cestách -2 za vinetou, pri nejakom druhu okysličenia za prítomnosti molekulárnych iónov: О 2 +, О 2 -, О 2 2 -, О 3 -, ako aj ako fluoridy O X F 2.
Stupne oxidácie atómov prvkov na danom mieste by mali byť zapísané cez symbol tohto prvku vrátane znamienka oxidačného stupňa a potom počet hodnôt, napríklad 4, na základe náboja ión, ktorý má zapísať znak vpravo, a potom 2+, SO 4 2-.
Oxidačno -významná sila atómov iných prvkov sa prejavuje v prítomnosti rôznych faktorov, z ktorých najdôležitejšie - elektronický prvok v Budíne, kroky oxidácie v reči, povaha síl ostatných účastníkov reakcie . Z'udnannya, pred ktorej skladom sa vstupujú atómy prvkov v maximálnom (pozitívnom) štádiu oxidácie, napríklad KO 4, K 2 2 O 7, HO 3, O 2, je možné vidieť iba v oxidácia. V spoluces je možné brať prvky na najnižšej úrovni oxidácie, napríklad H 3, H 2, H, môžu oxidovať a prejavovať sa v kvalite najdôležitejších. Zaznamenáva, scho za účelom pomsty prvkov v medziľahlých stupňoch oxidácie, napríklad H O 2, H 2 ,,, Cl 3, O 2, môže pododdelenie špecifické pre oxidáciu... Bez ohľadu na partnera v reakcii na tieto slová stavby a prijatia a dodávky elektroniky. Sklad obnovy a oxidovaných produktov je možné skladovať aj ako rôzne činitele, vrátane stredného stupňa pri takejto chemickej reakcii, koncentrácie činidiel a aktivity partnera v oxidačnom procese. Je nevyhnutné, aby šľachta zmenila úroveň oxidácie prvkov, a v oboch prípadoch, aby sa zmenil oxidačný stupeň, je to nevyhnutné pre šľachtu.
Naivazhivіshі oxiduje. Zavádzané halogény nafukujú kroky oxidácie -1, pričom forma fluóru na jód je oxidačná sila slabá (F2 môže byť obklopený vysokou agresivitou):
2H20 + 2F2 = 02 + 4HF
mussen O 2, navyše, kroky napučiavania oxidácie -2:
4Fe (OH) 2 + 02 + 2H20 = 4 Fe (OH) 3
Kyselina dusičná HNO 3 vykazuje oxidačnú silu na uvoľňovanie dusíka v oxidačnom stupni +5:
3Cu + 8HNO 3 (zriedený) = 3Cu (NO 3) 2 + 2NO + 4H 2 O
Kedykoľvek je schválená široká škála nových produktov:
NIE 3 - + 2H + + e= NO2 + H20
NIE 3 - + 4H + + 3 e= NO + 2H20
NIE 3 - + 5H + + 4 e= 0,5 N20 + 2,5 H20
NIE 3 - + 6H + + 5 e= 0,5N2 + 3H20
NIE 3 - + 10H + +8 e= NH4 + + 3H20
Glybín dusíka sa ukladá ako koncentrácia kyseliny, ako aj aktivita olova:
koncentrácia kyseliny
¾¾¾¾¾¾¾¾¾¾¾¾¾
NO 2 NO N 2 O N 2 NH 4 +
¾¾¾¾¾¾¾¾¾¾¾¾¾®
činnosť vedúceho vyšetrovateľa
Soľ kyselina dusičná ( nitrati) Môže byť použitý v kyslom prostredí a pri interakcii s aktívnymi kovmi v centre kaluže, ako aj v taveninách:
Zn + KNO 3 + 2KOH K 2 ZnO 2 + KNO 2 + H 2 O
Carská Gorilka- súčet koncentrovaných kyselín dusičných a chlorovodíkových, zníženie objemového pomeru 1: 3. Názov tsієї sumіshі je spojený s časom, takže nenájdete také vzácne kovy, ako je zlato a platina:
Au + HNO3 (koncentrovaný) + 4HCI (koncentrovaný) = H + NO + 2H20
Kyselina sirchana Oxidovaná sila H2S04 v koncentrovanom rozsahu pre zrnko vody v oxidačnom stupni +6:
C (grafit) + 2H2S04 (koncentrovaný) CO2 + 2SO 2 + 2H20.
Sklad výrobkov na obnovu je hlavnou činnosťou pri obnove a koncentrácii kyseliny:
SO 4 2- + 4H + + 2 e= S02 + 2H20
SO 4 2- + 8H + + 4 e= S + 4H20
SO 4 2- + 10H + + 8 e= H2S + 4H20
koncentrácia kyseliny
¾¾¾¾¾¾¾¾¾¾¾¾¾
¾¾¾¾¾¾¾¾¾¾¾¾¾
činnosť vedúceho vyšetrovateľa
Tieto soli sú často škodlivé ako oxidujúce, ak majú dvojitý charakter. Výrobkami obnovy cich spoluk sú spravidla chloridy a bromidy, ako aj jód:
MnS + 4HClO = MnS04 + 4HCl;
5Na2S03 + 2HIO3 = 5Na2S04 + I2 + H20
manganistan kalium KMnO 4 sa oxiduje na mangán v oxidačnom kroku +7. Falošne zo stredu, opačným spôsobom reakcie, sa zavádza do mladých produktov: do kyslých stredných - do solí mangánu (II), do neutrálneho - do oxidu manganičitého (IV) v manganistanovej forme MnO ( - OH) 2, v bujnom ióne MnO 4 2-:
kyslá stredná cesta:
5Na 2 SO 3 + 2KMnO 4 + 3H 2 SO 4 (zriedený) = 5 Na 2 SO 4 + 2MnSO 4 + 3H 2 O + K 2 SO 4
neutrálny stred:
3Na 2 SO 3 + 2KMnO 4 + 3H 2 O = 3Na 2 SO 4 + 2MnO (OH) 2 ¯ + 2KOH
kaluže stredná cesta:
Na 2 SO 3 + 2 KMnO 4 + 2 KOH = Na 2 SO 4 + 2 K 2 MnO 4 + H 2 O
kalium dichroman K 2 Cr 2 O 7, pred uložením molekuly, chróm vstupuje do oxidačného stupňa +6, є v prípade okyslenia silne oxiduje:
6KI + K 2 Cr 2 O 7 + 7H 2 SO 4 (s) = 3I 2 + Cr 2 (SO 4) 3 + 7H 2 O + 4K 2 SO 4
v neutrálnom strede:
3H2S + K2Cr207 + H20 = 3S + + 2Cr (OH) 3 + + 2KOH.
Uprostred oxidačnej sily je oxidácia sprevádzaná prítomnosťou H + a kovu v oblasti oxidácie. iónová voda H + vistupaє yak oxidujúci počas interakcie aktívnych kovov s riedením kyselín (s vinou HNO 3): Mg + H 2 SO 4 (riedenie) = MgSO 4 + H 2
Ioni metal pri relatívne vysokej úrovni oxidácie, ako sú zavedené Fe 3+, Cu 2+, Hg 2+, sa transformujú na vyššiu nízku úroveň oxidácie:
H2S + 2FeCl3 = S + + 2FeCl2 + 2HCl
Z rozdielov v soliach v kovoch to vyplýva:
2Al + 3CuCl2 = 2AlCl3 + 3Cu.
Novinky. Pred typickými v strede jednoduché rozprávanie aktívne kovy, ako kovy v kaluži a kaluži, zinok, hliník, zlato a iné, ako aj nekovy (voda, uhlík, fosfor, kremík): Zn + 2HCl = ZnCl2 + H2
C + 4HNO3 (koncentr., Gir) = CO 2 + 4NO 2 + 2H 2 O
Hlavnými funkciami vody sú anióny bez kyselín, ako sú Cl-, Br-, I-, S2-, H- a kovové katióny v dolnom stupni oxidácie:
2HBr (koncentrovaný) + H202 (koncentrovaný) = Br2 + 2H20;
2CaH2 + TiO2 2CaO + Ti + 2H2.
2FeSO 4 + H 2 O 2 (konc.) + H 2 SO 4 (zriedený) Fe 2 (SO 4) 3 + 2 H 2 O
Oxidačne známy dvojitý. Medzi jednoduchými slovami je oxidačne známy dvojitý prvok charakteristický pre prvky VIIA, VIA a VA skupiny, ktoré môžu zvýšiť aj znížiť ich oxidačné stupne.
Často víťazné ako oxidujúce, halogén na druhej strane, pre silnejšie oxidanty sa zdajú byť silnejšie (na vine je fluór). Oxidovaná stavebná kapacita sa zmení a objem stavebnej kapacity sa zvýši z Cl 2 na I 2. Zvláštnosť svetelnej reakcie jódu oxidovaného chlórom vo vodnom roztoku: I 2 + 5Cl 2 + 6H 2 O = 2 HIO 3 + 10HCl .
Kyseliny a halogény je їх soľ Pred uskladnením molekúl, ktoré obsahujú halogén v priemyselnom štádiu oxidácie, môže existovať viac ako len oxidácia:
S + NaClO 2 NaCl + SO 2
ale і vіdnovnikіv:
5NaClO 2 + 2KMnO 4 + 3H 2 SO 4 (zriedený) = 5 NaClO 3 + 2MnSO 4 + 3H 2 O + K 2 SO 4
Peroxid Aby sa pomstil kissen v oxidačnom kroku -1, v prítomnosti typických redukčných činidiel je prítomná oxidačná sila, takže kissen môže znížiť svoje oxidačné kroky na -2:
2KI + H202 = I2 + 2KOH
a v prípade interakcie so silnými oxidačnými činidlami sa prejavuje sila hlavného hrdinu (kroky rastu oxidovanej kyseliny na 0):
H202 + 2Hg (NO3) 2 = 02 + Hg2 (NO3) 2 + 2HNO3.
kyselina dusičnáі dusitany Pred skladom, ktorý obsahuje dusík v oxidačných stupňoch +3, sa môže použiť aj ako oxidačné činidlo: 2HI + 2HNO 2 = I 2 + 2NO + 2H 2 O,
tak a v úlohe odkazu: 2NaNO 2 (dil, gir) + O 2 = 2NaNO 3.
Infúzia kyslosti stredného stupňa z hľadiska produktov v reakcii je obzvlášť dobre implementovaná na zadku obnovy iónu manganistanu Mn04 -.
a) v kyslom prostredí„Podľa prvej schémy proti najlepšej možnej obnove atómu mangánu.
MnO 4 - + 8H + + 5e - → Mn 2+ +4 H20.
Súčasne sa stanovujú soli mangánu (II), ktorých anióny ležia v kyselinách, ale stred je kyslý. V kyslom prostredí sa teda tvorí MnSO 4, v soľnej vrstve MnCl 2. Je dôležité, že kovový mangán nemožno prijať, pretože kov v rade, ostatné kovy, sú častejšie vodnatejšie a oxidujú ionamіH +. b) v neutrálnom(Slabo studený alebo slabo kyslý stred) manganistan-ión sa zavedie do oxidu manganičitého MnO 2 Scho vipadaє z čiary pri čierno-hnedom obliehaní viglyadі
MnO 4 - + 2Н 2 О + 3е - → MnO 2 + 4ОН -.
Vo všeobecnosti často dochádza k prisatiu ruže.
v) vo veľmi zablatenom strede prenos elektrónov na veľké ťažkosti (prostredníctvom veľkej koncentrácie negatívne nabitých iónov ON -). Renovácia na mangánanový ión MnO 4 2-, ktorý je zelenší:
MnO 4 - + 1е - → MnO 4 2-
Spevácka úcta k potrebe byť preukázaná robotom s chrómovými (VI) polovicami. Vpravo je v kyslom strede veľmi silný v kyslom strede dichroman-ión Cr 2 O 7 2-, v strede kaluže je silná oxidačná sila, bez zmeny oxidačného stupňa Transformuje sa na chromát-iónCrO 4 2-, čo je ešte slabšia oxidačná sila.
Cr 2 O 7 2- + 2ОН - → 2CrO 4 2 + Н 2 О
Navpaki, chromát v kyslom stredne tvrdom dichromáte.
2CrO 4 2 + 2Н + → Cr 2 O 7 2- + Н 2 О
V kyslom prostredí sa ión Cr 2 O 7 2- upraví na ióny Cr 3+:
Cr207 2- + 14H + + 6e - → 2Cr 3+ +7 H20
V závislosti od konkrétneho prototypu a skutočných parametrov acidobázickej zásady je možné rozsah chrómu pozorovať buď pred obliehaním Cr (OH) 3, alebo v dôsledku amfotérnych síl chrómu (III) v kritickom komplexe anion 3. V každom produkte bude k dispozícii chrómová aktualizácia + III.
Na druhej strane, ak sa oxiduje chrómom v strede kaluže, potom oxidovanými produktmi budú chroman CrO 4 2-, ak sa oxidovaný pridá do kyslého prostredia, potom budú oxidované produkty Cr 2 O 7 2 -.
Vstrekovanie koncentrácie do skladu reakčných produktov
Vstrekovanie koncentrácie reaktívnych kvapalín do OVR sa s najväčšou pravdepodobnosťou prejaví pri aplikácii reakcií s kyselinou dusičnou a chlorovodíkovou.
Reakcie kyseliny dusičnej.
Nagadaєmo, tsі kyselina a súčasne і і oxidujúce, і tvorcovia stredu.
Kyselina dusičná reaguje, oxiduje, s kovmi, oxidmi a hydroxidmi kovov v medziľahlých stupňoch oxidácie, s nekovmi a oxidmi ig, takže nekov je v medzistupni oxidácie nahradený. Produkty obnovy kyseliny dusičnej spravidla tvoria súčet rechovínu (ktorý sa spravidla oxiduje), aj keď v prítomnosti koncentrácie sa rovnaký produkt zmieša v reakčnom súčte. Bulo experimentálnym spôsobom stanovil nástup zákonov:
Pridá sa koncentrovaná kyselina dusičná NIE 2 .
NO3 - + 2H + + 1e - → NO2 + H20
Kyselina dusičná sa zriedi rádovo. NIE.
NO 3 - + 4H + + 3e - → NO + 2H20
Kyselina dusičná sa ďalej riedi a reaguje s aktívnym prekurzorom (Mg, Ca, Ali atď.) K amónnej soli - dusičnanu NH 4 NIE 3 .
NO 3 - + 10H + + 8e - → NH4 + + 3H20
Sklad obnoviteľných produktov môže zahŕňať aj plynný dusík N 2, N 2 O.
1. V atmosfére fluóru horia také stiyki slová,
yak sklo (pri viglyadі vati), voda. Jeden z produktov bane je kissen, t.j. fluór yak oxiduje kyslejšie:
SiO2 + 2F2 → SiF4 + O2;
2H20 + 2F2 → 4HF + O2.
2. Aktívne si zamieňajte fluór s jednoduchšími slovami. So syrom a fosforom môžeme spolupracovať pri teplote suchého počasia (-190 ° C):
S + 3F2 → SF6;
2P + 5F2 → 2PF5.
Fluór oxiduje na vnútorné plyny navit deyaki (xenón),
pivo nie v spojení s gélom, neónom a argónom:
Xe + 2F2 → XeF4.
Najaktívnejšie nekovové, bujne prepletené nárastom objemu výkrikov, svetla, fluoridov vo vyšších stupňoch oxidácie a kvapalných vinyátov - fluóroplastov, a od ďalších z nich - z baní. Do fluóru pri izbovej teplote sa hodili kroky na prípravu fluoridu, galmová reakcia s fluórom - Al, Mg, Cu, Ni.
Nechajte fluór v kontakte s vodou, kým sa neabsorbuje, a naviňte ho mašľou nízke teploty(Až do -252 ° C ). V atmosfére fluóru na spaľovanie vody a platiny:
2F2 + 2H20 - 4HF + O2
Pred reakciami, v ktorých je formálne olovo fluór, prebiehajú reakcie distribúcie iných fluoridov, napríklad:
2CoF3 → 2CoF2 + F2
MnF4 → MnF3 + 1/2 F2
Fluór sa môže oxidovať aj v elektrickej zásuvke, okysličujúcim fluoridom OF2 a deoxidifluoridom O2F2.
Vo všetkých prípadoch fluór vykazuje oxidačné kroky -1
Chemikom v diaľke odneste difluoridové kysnutie, aby mohli s fluórom predstierať na slabej lúke:
2F2 + 2NаОН = 2NаF + OF2 + H2O.
Fluór dusíka nemôže zostať pozadu, ale v roku 1928 bol fluorid dusičitý NF3 odstránený nepriamou cestou z fluóru Otta Ruffa. Vіdomі a іnshі fluór zmiešaný s dusíkom. Keď získate prístup k jedlu, rozsvieti sa. Obec Vugilla spalakhu v atmosfére fluóru pri vysokých teplotách.
Zlato v chlade sa ešte viac zmieša s fluórom a keď je vyprážané, spaľuje nové. Platina, s mimoriadnou mysľou, nereaguje s fluórom, ale pri zahrievaní na 500-600 ° C nové spaľuje.
S bórom, kremíkom, fosforom a mish'yakom sa fluór používa v chladných podmienkach a tiež tvorí fluorid.
Keď fluór interaguje s oxidmi kovov za studena, nastavia sa fluoridové kovy a kissen; Je tiež možné schváliť oxyfluorid kovu (napríklad MoO2F2). Nekovové oxidy buď dodávajú fluór, napríklad SO2 + F2 = SO2F2, alebo ich nahradia fluórom, napríklad SiO2 + 2F2 = SiF4 + O2. Sklo častejšie reaguje s fluórom ;. Oxid dusičitý NO a NO2 sa ľahko pripúšťajú k fluóru pomocou formulácie nitrosylfluoridu FNO a nitritfluoridu FNO2. Oxid v uhlíku (II) privádza fluór počas zahrievania s roztokmi karbonylfluoridu: CO + F2 = COF2.
Hydroxid kovu môže reagovať s fluórom, čo umožňuje rozpustenie fluoridu kovu a kyslíka, napríklad 2Ва (ОН) 2 + 2F2 = 2BaF2 + 2Н2О + О2. vodné roztoky NaOH a KOH reagujú s fluórom pri 0 ° C podľa OF2.
Halogenidy kovov alebo nekovy sa v chlade vymieňajú s fluórom a fluór nahrádza všetky halogény.
Ľahko fluorizuje sulfidy, nitridy a karbidy. Hydridy kovov pripravené fluórom v chladnom fluoride kovu a HF; amiak (vo dvojiciach) - N2 a HF. Fluór je nahradený vodou v kyselinách alebo kovoch v їх soliach, napríklad НNО3 (alebo NaNO3) + F2 = FNO3 + HF (alebo NaF); v tvrdších mysliach Fluór je vitisnyaє kissen od cich spoluk, ktorý môže byť použitý ako sulfurylfluorid, napríklad Na2SO4 + 2F2 = 2NaF + SO2F2 + O2. Uhličitany a nekovové kovy reagujú s fluórom pri extrémnych teplotách; Súčasne existuje zmes fluoridu, CO2 a O2.
Fluór energeticky reaguje organickou rečou.
vypláchnite fluór vo vile stanі elektrolizom
thi-melted spoluks (HF in roztavený dihydrofluoride ofcium KH2F3).
Dzherel pre virobniztva Fluor slúži ako fluoridová voda, ktorá prebieha hlavne v prítomnosti kyseliny chlorovodíkovej H2SO4 · pre fluorit CaF2, alebo pri spracovaní apatitov a fosforitov .. na distribúciu iných fluoridov
2CeF4 = 2CeF3 + F2
Koncentrujte vodou, fluór bude jeden deň plynný - fluorovodík HF... Vodné roztoky fluorovodíka sa nazývajú kyselina fluorovodíková. Plyn podobný HF je plyn bez barier so štipľavým zápachom, ešte výraznejšie na mentálne organizmy a sliznice.
odmietanie Veľmi špeciálnym spôsobom odmietnutia je použitie kyseliny chlorovodíkovej na kazivku CaF2:
CaF2 + H2S04 = CaS04 + 2HF.
Fluór s vibuchickou interakciou s vodou pri nízkych teplotách a (pokiaľ ide o chlór) pri teplotách s roztokmi fluorovodíka:
H2 + F2 → 2HF.
Molekula fluorovodíka je silne polárna, μ = 0,64 · 10-29 Cl Energia vodných zlúčenín FH FH sa stáva približne 42 kJ / mol a priemerné stupne polymerizácie v plynnej fáze (pri teplote varu) ≈4. Navit v plynovom mlyne je fluorovodík skladovaný zo súčtu polymérov H2F2, H3F3, H4F4, H5F5, H6F6. Molekuly VF ľahko prežijú pri teplotách až 90 ° C. Vysoký teplotný pokles fluorovodíka zároveň zníži teplotu 3 500 ° C (viac ako teplota topenia volfrámu - naj žiaruvzdorného kovu) ). V prípade kaše - vo vode bude pokles teploty jasnejší pri teplotách až 2 000 ° C.
V HF kryštálovom mlyne sa tvoria ortorombické kryštály, ktoré sa skladajú do reťazcových štruktúr: rez HFH = 116 °, d (F-H) = 95 pm, d (FH) = 155 pm. analóg zyґzaґopodibnі
lantsyuga s rezaným HFH = 140 °) môže byť v polymérnom HF, v plynnej fáze.
Kyselina fluorovodíková. Veselé úrady je to všetko zahodené, za vinetou zlata a platiny. V priemere a v priemere je kyselina fluorovodíková ešte bežnejšia. Slabé razchini for absolútne neplatí pre cín, meď a bronz.
Odolný voči kyseline fluorovodíkovej a olovu, ktoré je možné pokryť guľôčkou fluoridu olovnatého, ktoré je možné použiť na ochranu kovu pred sfalšovanou zrúcaninou. K tomu olovo slúži a slúži ako materiál pre zariadenie na výrobu kyseliny fluorovodíkovej.
Ochladenie molekúl ~ F by sa malo uskutočniť pred strednými soľami kyseliny fluorovodíkovej a kyseliny, napríklad KHF2 (pomocou ktorej sa fluór odstráni elektrolýzou). Súčasne je rozdiel v počte halogenovodíkových kyselín, ktoré poskytujú iba stredné soli.
Charakteristický znak kyseliny fluorovodíkovej, ktorá je odvodená od všetkých ostatných kyselín, je pri soliach oxidu kremičitého SiO2 a kyseline kremičitej vynikajúco jednoduchší:
SiO2 + 4HF = SiF4 + 2H20.
Tetrafluorid kremičitý SiF4 - plyn, odparený počas reakcie.
Dіyuchi na oxide kremičitom, scho vstúpiť do skladu svahu, kyselina fluorovodíková ružové sklo, preto nie je možné ho získať v sklyanských nádobách.
Z organických kvapalín sa kyselina fluorovodíková používa na papier, drevo, korok, kyselinu uhličitú. Na plastoch je slabý, absolútne nie na parafíne, ktorý sa plazí kyselinou fluorovodíkovou v nádobách drvených z materiálu.
Sila HF ležať v prítomnosti vody. Suchá fluoridová voda nie je vhodná pre veľké množstvo kovov a nereaguje s oxidmi kovov. Akonáhle sa však reakcia spustí, je to už veľmi ďaleko od autokatalýzy, takže v dôsledku zmeny nastáva veľa jazdy a zlepšovania:
MO + 2HF = MF2 + H20
Ridky HF je silné ionizačné činidlo. Celá elektrolýza je nová, s vinetou kyseliny chloristej a HClO4, mimochodom:
HCl + 2HF ↔ ClH2 + + HF2-
V prípade fluorovodíka je kyslá sila uvedená na polovicu ako akceptory iónového fluoridu, napríklad BF3, SbF5:
BF3 + 2HF → FH2 + + BF4-
Amfotérne lúče uprostred najbohatšieho fluorovodíka є, napríklad fluorid hlinitý a chróm (III):
3NaF + AlF3 → 3Na + + AlF6-
(AlF3 - jaková kyselina)
AlF3 + 3BF3 → Al3 + + 3BF4-
(AlF3 - yak pіdstava)
Keď sú molekuly HF ionizované, fluorovodík sa vo vode nezamieňa.
Cena bola daná prvkom skupiny VIII hlavnej skupiny - vnútorným alebo vzácnym plynom, aspoň niektoré z koncov sa nazývajú elektronické gule. Elektronická konfigurácia atómov a prvkov je taká, že je nemožné ich priviesť k kovom ani k nekovom. Vonia týmito predmetmi, ako v prírodnom systéme, jasne distribuujú prvky na kov a nekov, ktoré zaujímajú miesto v ich blízkosti. Inertný alebo ušľachtilý gazi („šľachta“ víri zotrvačnosťou) sa niekedy môže prenášať k nekovom, aj keď čisto formálne, za fyzické znaky. Plyn na premenu plynu je možné ušetriť až na nízke teploty.
Energia v chémii je pre tieto prvky pozoruhodná. Pre xenóny a kryptóny sú polofluórované a kyslé. Bláznivo, vo svetle dňa, v priebehu dňa, pohľady hrali úlohu predkov.
Hodnota nekovových stôp, ktorá sa pre tieto atómy vyznačuje vysokou hodnotou elektrickej energie. Оіа zmeny hraníc od 2 do 4. Nekovy - účel prvkov hlavných skupín, dokonca aj prvkov, vignatok, aby sa stal vodou - s -prvok.
Požičiavajú sa všetky nekovové prvky (crim vodnyu) periodické systémy chemické prvky D. I. Mendeleva horný pravý rukáv, trikot, ktorého vrchná časť je fluór.
Zvlášť dôležité však bolo zamerať sa na nejednoznačné prostredie v periodickom systéme: v skupinách I a VII vedúcich skupín. Tse nie je vipadkovo. Na jednej strane je atóm vody, podobný atómom cudzích kovov, jedna elektronická guľa na jednej (a jedna na novú) elektronická guľa (elektronická konfigurácia 1s1), ktorá je chybou stavu mysle a ukazuje moc.
Voda vo veľkom počte, podobne ako kovové kaluže, vykazuje oxidačné kroky +1, zatiaľ čo výstup elektrónu atómom je dôležitejší, pre atómy iných kovov je menej dôležitý. Na druhej strane, atóm vody, podobne ako atómy halogénu, na dokončenie poslednej elektronickej gule, manželstvo jedného elektrónu, atóm vody môže zachytiť jeden elektrón, pričom ukazuje silu oxidačného činidla a jeho charakteristiku. halogénových oxidačných stupňov, -1 v hydridoch - z'єdnanové kovy s halogénmi - halogenidy. Ak privediete k atómu jeden elektrón, bude to dôležitejšie ako pri halogénoch.
S rozumom je voda H2 - plyn. Molekula jogína, podobná halogénom, dvojatómová.
Atómy nekovov sa spoliehajú na oxidy energie, takže sila priťahuje elektrickú energiu. Kvalita charakterizácie hodnoty elektrickej negativity, ktorá sa prirodzene mení v obdobiach a v skupinách (obr. 47).
fluór- najsilnejší oxidujúci atóm v chemických reakciách nie je k dispozícii pre elektrinu, takže ukazuje veľkú silu.
Konfigurácia novej elektronickej loptičky
Shnshі nekovy môžu ukázať extra silu, ak to chcú vo výrazne vyššej miere z hľadiska kovov; V obdobiach a v skupinách je dôležité, aby sa budova v prípade oxidačného činidla menila vo vírivom poradí.
Chemicky nekovové prvky celkom 161 Volanie trocha, ktoré je vrahuvati, je vidieť na 114 prvkoch. Dva nekovové prvky tvoria 76% hmotnosti pozemských osýpok. Ceysen (49%) a kremík (27%). Atmosféra obsahuje 0,03% hmotnosti kyslej v zemskej kôre. Nekovy sú skladované 98,5% hmotnosti roslínu, 97,6% hmotnosti muža. Mnoho nekovov - C, H, O, N, P a S - je biogénnych prvkov, ktoré je možné použiť na najdôležitejšiu organickú reč živých buniek: nápoje, tuky, sacharidy, nukleové kyseliny. Pred skladom povitrya, yakim mi dikhaєmo, existujú jednoduché a skladacie slová, ako aj fixácia prvkov nekovmi (kyslík kyslík, dusík, oxid uhličitý CO2, vodná para H2O atď.).
deň vody - prvok hlavy Vsesvita. Vesmírne objekty Bagato (plyny, hviezdy vrátane Sonce) sú viac ako z polovice uložené vo vode. Na Zemi vrátane atmosféry, hydrosféry a litosféry iba 0,88%. Je to trochu hmotnostné a atómová hmotnosť je ešte menšia. Nie je to skvelé miesto na stavbu, pretože zo 100 atómov kože na Zemi je 17 atómov.
Jednoduchá reč-nekovová. Budova. Fyzická sila
V jednoduchej reči sú atómy nekovov viazané cova-lentónom s nepolárnym kruhom. Palica je tvorená väčším elektronickým systémom, nižším v izolovaných atómoch. Súčasne jednotlivé (napríklad v molekulách vody H2, halogény Ki, Br2), podriadené línie (napríklad v molekulách syrkyho trónu (napríklad v molekulách kovalentných väzieb dusíka).
Ako už vidíte, jednoduché slová, nekovy môžu matkou:
1. Molekulárna Budova. S neobyčajnou mysľou je väčšina takýchto rečí plynná, a ak nie tvrdá, reči, a iba jeden bróm (Br2) je menší ako jeden. Všetky reči molekulárnych budov, tak lietajú. V pevnom mlyne je zápach taviteľný vďaka slabosti intermolekulárnej interakcie, ktorá redukuje molekuly v kryštáli a dochádza k jeho sublimácii.
2. atómová budova... Prejavy schválili kopijníci atómov. Prostredníctvom veľkých kovalentných väzieb zápachu sa to spravidla zdá byť veľmi ťažké, a či už ide o hady zviazané kovalentnými väzbami v ich kryštáloch (topenie, pary), veľkú vitalitu. Bagato tak rechovini mayut vysoká teplota topenia a varu, a prchavosť je dokonca nízka. (U dieťaťa je 47 sedadiel symbolmi tichých nekovových prvkov, pretože sa hodia iba do mriežok atómových kryštálov.)
Prvky bagata - nekovy vytvárajú sprchu jednoduchých slov - alotropické úpravy. Yak vi pam'yataєte, sila atómov sa nazýva alotropia. Allotropiu je možné viazať na malé skladisko molekúl a na rastúci budický kryštál. Alotropická modifikácia v uhlíku є grafit, diamant, karabína, fullerén (obr. 48).
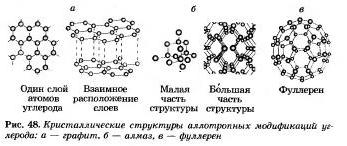
K malej 47. hviezde sú priradené elementárne nekovy, ktoré sú silou alotropie. Existuje teda viac jednoduchých nekovových slov ako viac, menej chemických nekovových prvkov.
Viete, že za vzácnym vínom (zlatým, stredným a deyaki), typickým pre stredne veľké víno, sú tri veľké kovy. A os jednoduchej nekovovej reči, gama farieb, má zmysel.
Bezprecedentné na veľkom význame v fyzická sila nekovy, napriek tomu je to z nejakého dôvodu nevyhnutné a deyakі їkh zagalny ryža. Všetky plynové frázy, vzácny bróm, ako aj druhy kovalentných kryštálov - dielektrikum, ako aj všetka najnovšia elektronika na vytváranie chemických zvukov. Kryštály sú neplastické, ak ide o deformáciu bezbožnosti, zničenie kovalentných väzieb. Veľa nekovov nevykazuje kovové odlesky.
Veselé úrady
Tiež znamenali pre atómy nekovov a tiež pre jednoduché slová, ktoré objasnili, charakteristické ako oxidačné, tak aj silové.
Oxidácia sily jednoduchých slov nekovov
1. Oxidačná sila nekovov sa prejavuje na prvom mieste v prípade ich interakcie s kovmi (ako viete, hodili to predkovia):

Oxidačná sila chlóru Сl2 je výraznejšia, nižšia v prípade šedej a kovu je Re, čo je v stupňoch oxidácie menej +2 b +3. oxidovať na vyšší stupeň oxidácie.
2. Väčšina nekovov vykazuje pri interakcii s vodou oxidačnú silu. V dôsledku toho sa vytvoria lietajúce vody.
3. Buďte nekovom v úlohe oxidačného činidla v reakciách s týmito nekovmi, ktoré môžu mať nižšiu hodnotu elektriny:
Elektronegativita hrozna je vyššia, nižšia ako fosfor, takže dochádza k oxidácii sily.
Elektronegativita fluóru je vyššia, nižšia vo všetkých ostatných chemických prvkoch, čo je spôsobené tým, že oxidačné činidlo je silné.
Fluór je najsilnejšie oxidačné činidlo z nekovov a pri reakciách vykazuje iba oxidačnú silu.
4. Oxidačné sily nekovov sa objavujú v reakciách s činmi skladacie slová... Nielen kissen, ale a iné nekovy, ale môžu byť aj oxidačnými činidlami v reakciách so skladacími jazykmi - anorganickými a organickými.
Silne oxidujúci chlór Сl2 oxiduje chlorid zaliz (II) na chlorid zaliz (III).
Pam'yataєte, zychay, ako reakciu na nenásilný z'єdnanni - stuženú brómovú vodu.
Vіdnovnі sila jednoduchých rečí - nekovy
Pri pohľade na reakcie nekovov jeden z nich znamenal, že v prítomnosti trosiek jeden z nich ukázal silu oxidačného činidla a posledný ukázal silu vodcu.
1. Podľa redukcie na fluór majú všetky nekovy (navit kisen) veľkú silu.
2. Zrozumіlo, nekovy, fluór fluór, slúžia ako redukčné činidlá pri interakcii s kisne:

8 Bagato nemetelli môže pôsobiť ako olovo v reakciách s oxidačnými ryhami:
Existujú také reakcie, pri ktorých sa jeden a ten istý nekov okamžite oxiduje, najdôležitejším spôsobom je reakcia autooxidácie-samoobnovy.
Otzhe, vrecia na pidib'amo! Väčšina nekovov sa môže objaviť v chemických reakciách, a to ako v úlohe oxidačného činidla, tak aj v úlohe vodcu (okrem samotného fluóru).
Nekovy vodnevі spoluki
Vďaka horlivej sile všetkých nekovov є zakladaniu letných vodných rastlín vo veľkom počte nekovov existujú nižšie stupne oxidácie.
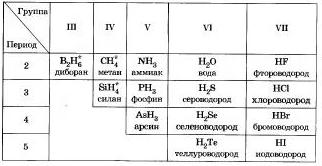
Zdá sa, že väčšinu jednoduchých ci je možné odmietnuť bez zameniteľného nekovu, ktoré sa majú syntetizovať.
Vm prívody vody nekovy sú spojené s polaritou polarity, s molekulárnym buddovom a v prípade mimoriadnych myslí є plynmi, okrem vody (ridina). Lla vodnevyh z'udnan nonmetals sa vyznačuje klenutým člnkom k vodi. META a enlan v žiadnych praktických nesschinnі. Hydroxid amónny, ak je rozpustený vo vode, sa používa na vopred pripravené dosky - hydroxid amónny.
Okrem rozpoznateľných autorít ukazuje voda a polovica nekovov v oxidicko-zásaditých reakciách vždy autoritu vedúcich predstaviteľov, a dokonca aj v nich môže nekov znižovať oxidačné kroky.
Nekovové oxidy a všeobecné hydroxidy
V nekovových oxidoch sú väzby medzi atómami kovalentne polárne. Médium molekulárnych oxidov-plynné, rydki (prchavé), tuhé (prchavé).
Oxidy nekovov je možné rozdeliť do dvoch skupín: nesoľné a ľadotvorné. Keď sa kyslé oxidy rozkladajú, vo vode sa usadzujú hydráty oxidov - hydroxidy, pre ich povahu - kyseliny. Kyseliny a kyslé oxidy v dôsledku chemických reakcií tvoria soli, v niektorých nekovoch sa oxidujú.
Oxidy a hydroxidy typu sú kyseliny, v niektorých nekovoch vykazujú oxidačné kroky, ktoré sú dôležité pre skupinové číslo, takže ak sú dôležité, nazývajú sa potraviny. Pri pohľade na periodický zákon charakterizovali aj svoj sklad a silu.
Posilnenie kyslej sily oxidov a shdronepdop V hraniciach jednej vedúcej skupiny, napríklad skupiny VI, napríklad začína pravidelnosť zmien v sile ostatných oxidov a hydroxidov.
Ak sa v nekove vytvoria dva alebo viac kyslých oxidov, a to znamená, že oba druhy kyslých kyselín, potom kyslosť nekovu akceptuje vyššie úrovne oxidácie nekovu.
Oxidy a kyseliny, v ktorých sú hlavným oxidačným krokom nekovy, môžu vykazovať iba oxidačnú silu.
Oxid a kyselina, nekovové, v medziľahlých stupňoch oxidácie môžu vykazovať oxidáciu aj všeobecnú silu.
praktická práca
1. Pred akýmikoľvek elektronickými domovinami ukis prvky-nekovy?
2. Čo sú nekovové prvky є biogénne?
3. Aké faktory sú valenčné kapacity nekovových atómov? Pozrite sa na aplikáciu atómov a sestier.
4. Prečo sú niektoré nekovy s mimoriadnou mysľou - gazi, іnshі - tvrdé žiaruvzdorné slová? 5. Viesť zadky jednoduchých nekovových slov tak, aby ich bolo možné v malom kamenivovom mlyne počuť s veľkou mysľou: a) podobné plynu, b) hrubé, c) pevné.
6. Sklad pre účasť nekovov. Aký výkon (alebo oxidácia alebo prívod) vykazuje v týchto reakciách nekovy?
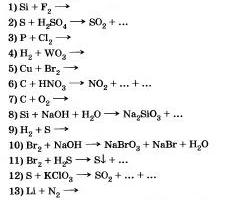
Aké sú dôvody vyššej teploty vody a kyseliny chlorovodíkovej, ktorá je bližšia teplote vody a vodíkového selénu?
7. Prečo je metán ráno rýchly a v druhom silný na vypožičanie: fluorovodík je rýchly pred zahrievaním, jód-voda aj pri slabom zahrievaní sa ukladá na jód a vodu?
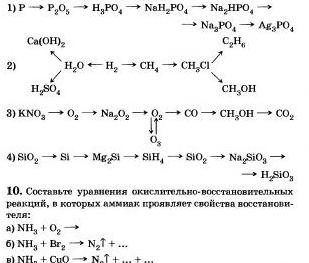
8. Napíšte správne reakcie, pomocou ktorých môžete ísť na:
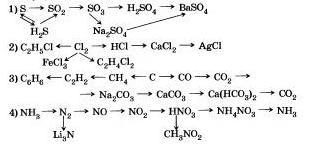
9. Napíšte podobné reakcie, pomocou ktorých môžete ísť na:
12. Prostredníctvom medzery prešli pomstou 10 g tekutého sodíka 20 g vody. Yaka sil a v akom druhu wyde?
Druh: 0,25 mol NaHS.
14. Počas spracovania 30 g vapnyaku s kyselinou chlorovodíkovou sa 11 g odobralo v oxide uhličitom. Yaka Masova Chastka na uhličitan vápenatý v prírodnom vapnyaku? Odpoveď: 83,3%. 15. Zastosovana v lekárskej jódovej tinktúre є 51% roztok kryštalického jódu v etylalkohole. Yaky obsyag alkohol, yaky kapacita 0,8 g / ml. potrebujete pripraviť 250 g takej veľkosti?
Typ: 297 ml. 16. Suma 34 g kremíka, grafitu a uhličitanu vápenatého s hmotnosťou 34 g sa tryskala s hydroxidom sodným a spracovala s 22,4 litrami plynu (n.o.). Pri spracovaní takej časti sumy kyselinou chlorovodíkovou sa odstránilo 2,24 litra plynu (N. N.). Navštívte hromadný sklad sumy.
Vzorka: 14 g 81: 10 g C; 10 g CaCO2.
17. Plynný amiak s objemom 2,24 l (n.u.) 20 g množstva kyseliny fosforečnej v hmotnostnom zlomku 49%. Yaka sil je hotové, yaka її masa?
Typ: 11,5 g
19. Aký objem amiaku je potrebný na odstránenie 6,3 tony kyseliny dusičnej, ktorá je potrebná na spotrebu 5%?
Typ: 2352 m3.
20. Zo zemného plynu s objemom 300 litrov (ND) bol acetylén odstránený z veľkej časti metánu v plyne, 96%. Visnagte yogo obsyag, yaksho vyhіd product 65%.
Pohľad: 93,6 l.
21. Najprv začnite štruktúrny vzorec v sacharidoch s pomerom 1 862 a hmotnostným zlomkom v uhlíku 88,9%. Zdá sa, že v uhľohydrátoch v spojení s roztokom amoniaku je oxid média.
Úloha nekovov v živote ľudí
Nekovy v živote ľudí zohrávajú veľkú úlohu, pretože bez nich život nie je nenávistný nielen pre ľudí, ale aj pre tieto živé organizmy. Aje zavdyaki tak nekovové prvky Yak Kissen, v uhlí, vode a dusíku sa etablovali aminokyseliny, pre ktoré existujú fľaše, bez ktorých nie je možné žiť na Zemi pre každého.
Pozrime sa s úctou na nasledujúci obrázok, na ktorom sú uvedené základné nekovy:

A teraz porozumieme nekovovým akciám podrobnejšie a významu ich významu, pretože vonia v živote ľudí a v ich organizme.
Život ľudí treba hľadať v minulosti, ako je to v dome, a na každom inom mieste sú nekovy a ich znalosti. Tí, ktorí stratili funkcie nášho tela, sa starajú o bozk a pridávajú sa k nim dusík a ďalšie slová podobné plynu a samy sa zmocňujú našich závratných návykov. V priebehu biológie tiež uvidíte, že všetky funkcie tela sú jasne spojené s prejavom.
V dôsledku prieniku zubného UV viprominuvannya, na ochranu nášho tela, ozónu stavati.
Taký potrebný mikroelement, ako sirka, v tele ľudí je v úlohe minerálnej krásy, ako aj robotníci, shkira, nigty a vlasy, budú zdraví. Tiež nejde o to zabudnúť, ale sirka sa stará o osud tkanív chrupavky a cysty, pomáha leštiť robota suglobov, čím sú naše tkaniny dôležitejšie pre zdravie ľudí.
Anióny k chlóru tiež hrajú dôležitú biologickú úlohu pre ľudí, pretože sa podieľajú na aktivácii enzýmov. S pomocou pomoci sa dostanem do priateľského stredu v slunk a získam osmotický stisk. Chlór sa spravidla konzumuje v tele ľudí, varí kuchynskú soľ, keď ju dostane.
Existuje mnoho dôležitých vlastností, ako napríklad nekovy, ktoré kladú na ľudský organizmus, a ktoré žijú s organizmami, stagnujú a v niektorých mladých hlúposti.
skladovanie nekovov
deň vody
Takáto rozmanitosť nekovov, ako je voda, sa v chemickom priemysle široko používa. Používa sa na syntézu amoniaku, metanolu, chlórovej vody, ako aj na hydrogenáciu tukov. Rovnako sa nemôžete obísť bez účasti vody, ako obnovy a v prípade virobnstvі bagatokh metal a іkh z'єdnan.
Voda je v medicíne široko používaná. Pri spracovaní rán a pri zupinkách iného krvácania je zlomyseľné vyrobiť tri haldy peroxidu vody.
chlór
Na výrobu kyseliny chlorovodíkovej, gumy, vinylchloridu, plastov a organických odpadových produktov používajte chlór. Yogo vikoristovuyut v takýchto sľuboch, ako je textil a papier, ako zmiešaný kabát. V súčasnosti je chlór nepostrádateľný pre infekciu pitnej vody, pretože s oxidmi volodymy má viac dezinfekčný účinok. S takou silou, vodou a chlórom a vodou.
Na lekárske účely je chlorid sodný spravidla vo forme fizrozchínu. Na tomto základe vibrujú veľa vodou riediteľných kvapalín.
sirka
Taký nekovový, yak sirka, vicoristovuyt na výrobu kyseliny sirchánovej, strelného prachu, sirnikiv. Tiež je možné zmraziť počas vulkanizácie gumy. Zostaňte doma s farbnikmi a luminoformi. A koloidná sirka je v medicíne potrebná.
Syrka poznala stagnáciu v silskom štáte. Її vikoristovuyut, jakový fungicíd, na boj s deťmi.
Pri syntéze polymérnych materiálov, ako aj pri príprave iných liečivých prípravkov sa široko používajú také nekovy, ako je jód a bróm.







