Kyselina chlorovodíková plus kyselina. Otrimannya sirkovodnyu
HODNOTA
Sirkovodenє plyn bez barov s charakteristickým zápachom zhnitej fľaše.
Pre počasie je veľmi dôležité stúpať pri teplotách -60,3 o С a silnejšie pri -85,6 o С.
2H2S + 302 = 2H20 + 2S02.
Ak do polovice vody vnesiete studený predmet, napríklad porcelánovú šálku, tak sa teplota o polovicu výrazne zníži a voda sa zoxiduje len na bielu vodu, ktorá sa usadzuje na miske očami sladkej vody. :
2H2S + 02 = 2H20 + 2S.
Sirvodden ľahko spí; súčet joga s prelomom dňa. Sirvodden je ešte otruynejší. Triviálne zithannya povitrya, ako sa pomstiť za plyn z malých množstiev, zlomyseľne dôležitá frustrácia.
Pri 20 o W, jeden objem vody razchinyaє 2,5 objemu vody. Rozchin sirvodnu pri vode sa vola s vodou... Pri státí na zákrutách, najmä na svetlách, sirvodnevoy voda skor bude kalamutnoy forma sirka, tak sa uvidi. Tse vіdbuvaєtsya v dôsledku oxidovanej vody kyslé potraviny.
Otrimannya sirkovodnyu
o vysoká teplota sirka vzaєmodin s vodnem, fixačný plyn sirvodin.
V praxi sa sirwater používa na rozpustenie iných riedení kyselín na suchom kove, napríklad na sulfidovej soli:
FeS + 2HCl = FeCl2 + H2S.
Čistá voda môže byť upravená hydrolýzou CaS, BaS alebo A1 2 S 3. Najčistejší plyn prúdi v priamej reakcii voda a voda s teplotou 600 °C.
Chémia moci
Rozchin sіrvodnuyu vіdі mak vіdlivostі kyselina. Sirwater je slabá dvojsýtna kyselina. Vona disossiu stupі často a hlavne na prvom shchableі:
H2S↔H+ + HS- (Ki = 6 x 10-8).
Disociácia na inej úrovni
HS - ↔H++ S2- (K2 = 10-14)
počítadlo je v najmenšom kroku.
Sirevodn je silným lídrom. Keď sa silné oxidačné vína oxidujú na oxid siričitý alebo kyselinu sírovú; glybina oxidovaná na uloženie podľa typu odtoku: teplota, rozsah pH, koncentrácia oxidačného činidla. Napríklad reakcia s chlórom rozprúdi reakciu na roztok kyseliny chlorovodíkovej:
H2S + 4CI2 + 4H20 = H2S04 + 8HCl.
Stredné soli sa nazývajú sulfidy.
Zastosuvannya sirvodnya
Zastosuvannya sirkovodnyu skončiť s amalgamáciou, ktorá je vopred spojená s vysokou toxicitou. Získané poznatky o skladovaní v laboratórnej praxi sú precipitátom dôležitých kovov. Slúži ako syruvina na odstránenie kyseliny sirchanovej, sirka v elementárnom viglyade a sulfidive
Nastavte úlohy
DODATOK 1
| Zavdannya | Uistite sa, že máte pre H 2 S trochu dôležitejšiu vodu. |
| rozhodnutie | Zmena hmotnosti plynu na hmotnosť plynu odoberaného v rovnakom systéme, pri rovnakej teplote a v tom istom zlozvyku sa nazýva prípustná kapacita prvého plynu iným spôsobom. Veľkosť indikátora ukazuje, že sa vyvinul prvý plyn, ktorý je dôležitý alebo je potrebný pre iný plyn. Zvyčajná molekulová hmotnosť sa berie najmenej 29 (s urahuvannya namiesto dusíka, kyslých a iných plynov). Znamená to, že chápanie "zjavnej molekulovej hmotnosti potravy" vikoristovuєs šikovne, napriek súčtu plynov. D vzduch (H2S) = Mr (H2S) / Mr (vzduch); D vzduch (H2S) = 34/29 = 1,17. Mr (H2S) = 2 x Ar (H) + Ar (S) = 2 x 1 + 32 = 2 + 32 = 34. |
| vyhliadka | Hydrochlorid H 2 S je dôležitý pre obrat 1,17 krát. |
DODATOK 2
| Zavdannya | Poznajte percento vody v množstve plynu, pri ktorom objeme časti sa kyselina stáva 20%, voda - 40%, voda je 40%, voda je voda H 2 S. |
| rozhodnutie | Niektoré časti plynu sú naplnené molárom, tobto. s časťami niekoľkých slov, cenami dedičstva z Avogadrovho zákona. Viem, vymažem molekulovú hmotnosť súčtu: M r podmienené (zmes) = φ (0 2) × M r (0 2) + φ (H 2) × M r (H 2) + φ (H 2 S) × M r (H 2 S); |
| Pomenovanie parametra | Hodnota |
| Predmet clanku: | Sirkovoden |
| Kategória (tematická kategória) | Hodil, že zvaryuvannya |
Otrimannya sіrki
Veselé úrady sirki
Pri izbovej teplote voda vstupuje do reakcie z ortuti. S úpravou teploty sa aktivita výrazne zvýši. Pri zahrievaní systém nereaguje na stred jednoduchá reč, Pre víno vnútorných plynov, dusíka selén, telúr, platina zlato, irídium a jód. Sulfidi dusík a zlato sa odstraňujú nepriamou cestou.
- Spojenie s kovmi
Syrka viyavlya oxidácia sily v dôsledku interakcie sú sulfidy nastavené:
- Vzaєmodia s vodou zvýšiť na 150-200 ° С:
H2 + S = H2S.
- Vzaєmodiya z kisnem
Voda horí v kyseline pri 280 ° C, striedavo pri 360 ° C, pri ktorej je nastavený súčet oxidov:
S + 02 = S02;
2S + 302 = 2S03.
- Kombinácia s fosforom a uhlíkom
Pri zahrievaní bez prístupu k energii reaguje voda s fosforom, uhlíkom a oxidovanou energiou:
2P + 3S = P2S3;
- Kombinácia s fluórom
V prítomnosti silných oxidačných činidiel majú tieto sily:
S + 3F2 = SF6.
- Vzaєmodiya zі skladanie slov
Pri prepojení so skladacími slovami syrky je to ako vodítko:
S + 2HN03 = 2NO + H2S04.
- Neprimeraná odozva
Syrka je zdravá pred neprimeranými reakciami, keď sa vytvorí interakcia s lúkou, sulfidmi a síranmi:
3S + 6KOH = K2S +403 + 2K2S-2 + 3H20.
- 3 pôvodné rudy
- Pri ohrievaní bez prístupu k jedlu
FeS2 = FeS + S.
- Oxidácia vody v prípade nedostatku kyslosti
2H2S + 02 = 2S + 2H20.
- Z výstupných plynov hutníckych a koksovacích pecí, s ohrevom za prítomnosti katalyzátora
H2S + S02 = 2H20 + 3S.
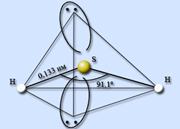
Vodneve z'єdnannya sirki - sirwater H2S ... Sirvodn je kovalentne z'єdnannya. Molekuly sú analogické molekulám molekúl vody, atóm vody je prenesený zo štádia sp 3-hybridizácie, ale molekuly vody molekuly vody neprijímajú. Atóm sirki mensh elektronegatívne, nіzh atóm sisnyu, maє väčšia veľkosť i, jačí dedičstvo, mením hustý náboj. HSH valenčný rez je 91,1° a H-S pásmo je 0,133 nm.
Sirvododen je svedkom toho, že vidi. Klasifikácia a zvláštnosti kategórie "Siroden" 2014, 2015.
Bilančné zásoby komponentov cich sa skladujú na poli v hraniciach dodávok plynu, plynového kondenzátu, plynu a ropy, kde: - skladovať zásoby plynu pri zásobách najmenej 10 miliárd m3; - zásoby cich komponentov vo vinohradníckej produkcii sa nestávajú ...
Otrunnya neidentifikované rіdinami Vzhivannya pomilkovo abnormálne, podporované, scho etylovy (kharchoviy) alkohol alebo voda, je nemožné produkovať rіdin, kým organizmus nie je odrezaný. Známky takéhoto slimáka: b_l pri shlunku, vykĺbenie shlunku, ....
Malý. 2.4. Viparník Mal. 2.3. Desorbér Mal. 2.2. Malý absorbér. 2.5. Výmenník tepla "potrubie v potrubí" Metóda nízkoteplotnej separácie sa široko používa na: odvlhčovanie plynu; vidieť kondenzát z plynu rodov plynového kondenzátu na ....
NA PLYN NA DLHÚ DOPRAVU. POTRAVINY NA ČISTENIE TOHTO PRÍPRAVKU ROZDIL 1 Obr. 2. Izolácia hlavného potrubia Zemný plyn, odkiaľ pochádza z hlbokých dier, pomstiť domy pevné častice (piesok, vodný kameň), kondenzát ...
Veselé úrady Fyzická sila Pre duchaplné mysle je sirvodden plyn bez stodoly, kvôli silnému charakteristickému zápachu skazených vajec. Tm = -86 ° С, Ткіп = -60 ° С, vo vode hnije, pri 20 ° С sa v 100 g vody vypustí 2,58 ml H2S. Duzhe otruyna, pri vdýchnutí wiklikє ....
Molekula sirvodnyu Sirvodn je non-stodolný plyn s vôňou skazených vajec. Je dobré ísť do vody (pri 20 ° C v 1 objeme vody je to 2,5 objemu vody). Voda môže byť odmietnutá bez priemerného času vody s vodou pri zahriatí, alebo to môžete nazvať ...
Veselé úrady
Fyzická sila
Pre duchaplné mysle je sirvodden plyn bez stodoly, kvôli silnému charakteristickému zápachu skazených vajec. T pl = -86 °C, T bal = -60 ° С, zhnitý vo vode, pri 20 ° С sa v 100 g vody rozpustí 2,58 ml H 2 S. fatálny výsledok... V prírode je možné vidieť skladisko sopečných plynov, predstierať útlak vysokých a organických organizmov. Dobrý roztok vo vode, pri vypracovávaní zafixujem slabú kyselinu chlorovodíkovú.
- Mať vodný roztok voda je slabá v sile slabej dvojsýtnej kyseliny:
H2S = HS- + H+;
HS- = S2 + H+.
- Sire voda na horenie pri povitri Sinє half-m'ya. V prípade prepojeného prístupu je zriadený platný certifikát:
2H2S + 02 = 2H20 + 2S.
Pri obrovskom prístupe do ohniska ohniska by sa voda mala vyrábať pred schválením oxidu oleja (IV):
2H2S + 302 = 2H20 + 2S02.
- Sirkhoven je schopný dodať silu. Falošná voda môže byť oxidovaná z vody na suchú vodu, čistý plynže kyselina sirchanová.
Napríklad vyhrajte zebarvlyu bromnu vodu:
H2S + Br2 = 2HBr + S.
vzaєmodі s chlórovou vodou:
H2S + 4CI2 + 4H20 = H2S04 + 8HCl.
Strum voda môže byť vypálená, vikorist a oxid olovnatý, takže reakcia dohliada na veľké teplo:
3Pb02 + 4H2S = 3PbS + S02 + 4H20.
- Vzaєmodiyya sirkvodnyu іf sіrchistiem plyn vikoristovuyutsya na odstraňovanie vody z odchádzajúcich plynov metalurgickej a kyseliny chlorovodíkovej virobniztva:
S02 + 2H2S = 3S + 2H20.
Z cim procesu sa viaže založenie pôvodného semena pri vulkanických procesoch.
- Pri hodinovom prechode čistého plynu a vody cez lúku sa nastaví tiosíran:
4S02 + 2H2S + 6NaOH = 3Na2S203 + 5H20.
- Reakcia zriedenej kyseliny chlorovodíkovej a sulfidu zaliz (II).
FeS + 2HCl = FeCl2 + H2S
- Interakcia sulfidu hlinitého so studenou vodou
Al2S3 + 6H20 = 2Al (OH)3 + 3H2S
- Priama syntéza z prvkov aby ste zistili, či nad roztopenou vodou chýba voda:
H2 + S = H2S.
- Načítanie sumy parafínu zo sirkoy.
1.9. Kyselina chlorovodíková a soli
Kyselina vodíková priťahuje všetku silu slabých kyselín. Vona reaguje s kovmi, oxidmi kovov, bázami.
Jakova dvojsýtna kyselina rekonštituuje dva typy solí - sulfid a hydrosulfid ... Hydrosulfidy sú dobré pre vodu, sulfidy dažďových a zemných kovov, ako aj sulfidy dôležitých kovov, ktoré sú prakticky nedeštruktívne.
Sulfidy železných a neželezných kovov nie sú predvarené, sulfidy sú typicky stužené, napr. sulfid medi (II), nikel a olovo - čierna, kadmium, india, cín - zhovt, surmi - pomaranč.
Iónny sulfidový kov M2S môže mať štruktúru typu fluoritu, dermálny atóm vody je kocka s 8 atómami v kove a dermálny atóm kovu je štvorsten so 4 atómami syrky. Sulfid typu MS je charakteristický pre kovy kalových zemín a štruktúru typu chloridu sodného, dermálneho kovového atómu a výboja oktaédra z atómu prvého stupňa. So silnejším kovalentným charakterom je spojenie kov-syr realizované štruktúrou s nižšími koordinačnými číslami.
Sulfidy kovov hrubého čreva vznikajú v prírode ako minerály a rudy, slúžia ako syruvina na odstraňovanie kovov.