Prezentácie neorganických prejavov. Platnosť klasifikácií prejavov. neorganické prejavy
Anorganické reči - také chemické spolky ako u bioľudí neuberajú z uhlia (okrem kyanidov, karbidov, uhličitanov a niektorých tradičných), ktoré sú tradične
Klasifikácia neorganických prejavov je urážlivá. Existujú jednoduché slová: nekovy (H2, N2, O2), kovy (Na, Zn, Fe), amfotérne jednoduché slová (Mn, Zn, Al), vzácne plyny (Xe, He, Rn) a skladacia reč: Oxid (H20, C02, P205); hydroxy (Ca(OH)2, H2S04); soli (CuSO4, NaCl, KNO3, Ca3 (PO4) 2) a binarny spoluks.
Molekuly jednoduchých (jednoprvkových) slov sú uložené len z atómov jediného (jednoho) typu (prvku). Zápach nevychádza z drzých reakcií a nevychádza pred prijatím týchto prejavov. Je ľahké hovoriť vlastným spôsobom používať kov a nekov. Jasné hranice medzi nimi neukazujú dvojitú silu prostredníctvom sily jednoduchých prejavov. Prvky Deyakі okamžite odhaľujú silu a kov a nekov. Їx sa nazývajú amfotérne.
Vznešené pohľady – najneorganickejšie reči triedy; smrad vir_znyayayutsya pre-pre tých, ktorí majú špeciálnu kapacitu. VIIIA-skupina.
Stav dejakykh prvkov sa skladá z niekoľkých jednoduchých prvkov, ktoré sú vnímané ako budhizmus a moc, nazývané alotropia. Pre prvky C je možné použiť zadky, ktoré zafixujú diamantovú karabínu a grafit; Pro - ozón a bozk; R - bilium, chervony, čierna a іnshі. Takýto jav možno dosiahnuť zmenou počtu atómov v molekule a usporiadaním budovy atómami rôznych kryštalických foriem.
Okrem jednoduchých základných tried neorganických rečových riadkov zahŕňajú skladacie spoloky. Skladacie (obojsmerné, viacprvkové) riadky reči sú rozumné na zhromažďovanie chemických prvkov. Molekuly Їх sú zložené z atómov nový druh(Riznykh prvky). Pri rozklade v chemických reakciách smrad vytvorí pár slov. Zdieľajte na show, a soľ.
V minulosti sa atómy kovov triedili podľa hydroxylových skupín (alebo jednej skupiny). Tsі polčas ísť do rastlín (lúky) і nehlásené pri vode.
Oxydis sú uložené v dvoch prvkoch, s jedným viazaním є kissen. Vôňa nie je soľotvorná a soľotvorná.
Hydroxy - reťazec slov, ktoré sa vytvárajú pri interakcii (priamej alebo nepriamej) s vodou. Označujú sa: podriadenie (Al (OH) 3, Ca (OH) 2), kyseliny (HCl, H2SO4, HNO3, H3PO4), (Al (OH) 3, Zn (OH) 2). Súhrou rôznych typov hydroxidov vzniká zmes soli.
Solitizovať v strede (uložiť z katiónu a aniónu - Ca3 (PO4) 2, Na2SO4); kyslá (na nahradenie atómov vodou v prebytku kyseliny, ktorá môže byť nahradená katiónmi -NaHS03, CaHPO4), zásaditá (môže byť uložená v hydroxo-aboxoskupine - Cu2CO3 (OH) 2); sub (na nahradenie dvoch rôznych chemických katiónov) alebo/alebo komplexné (na nahradenie dvoch nadbytočných kyselín) soli (CaMg (CO3) 2, K3).
Binárni spoluky (dosiahnuť veľkú triedu reči) ísť na kyseliny a bez kyselín (H2S, HCl); bezkyselinové soli (CaF2, NaCl) a iné spolukyslíky (CaC2, AlH3, CS2).
Anorganické reči nezakrývajú uhlíkovú kostru, ktorá je základom organických spolucov.
V organizme sú ľudia jaky (34%), teda anorganické spolky. Do jeho zvyšku sa na prvé miesto dopraví voda (60 %) a vápenatá soľ, ktoré sú dôležité pre kostru človeka.
Anorganická reč v ľudskom tele je zastúpená 22 chemickými prvkami. Väčšina z nich je v kovoch. Už kvôli koncentrácii prvkov v tele ho nazývajú mikro- (namiesto v tele nie viac ako 0,005 % hmoty) a makroprvky. Nepostrádateľné mikroelementy pre telo sú jód, zalizo, med, zinok, mangán, molybdén, kobalt, chróm, selén, fluór. Nádej na život v organizme je nevyhnutná pre normálny život človeka. Makroelementy ako vápnik, fosfor a chlór sú základom tkanín bagatokh.
Filozofická pravda: všetko v našej spoločnosti je prijateľné, - spravodlivé pre klasifikáciu prejavov a autorít. Vo vesmíre na našej planéte dochádza k veľkým zmenám reči, pričom všetky sú zbavené 90 chemických prvkov. V prírode vznikajú prejavy vyvolané prvkami s poradovými číslami od 1 do 91 vrátane. Prvok 43 je technický prvok, v dánskej hodine nebol v prírode na Zemi odhalený, pre tento prvok nie je málo stabilných izotopov. Vyhrajte buv otrimaniy po kúsku ako výsledok jadrovej reakcie... Hviezdičky a názov prvku je z vlašských orechov. téhnos - kus.
Všetko pozemské prirodzené veselé prejavy, Inšpirovaný 90 prvkami, možno rozdeliť na dva skvelé typy – anorganické a organické.
Organické frázy sa v uhlí nazývajú spoluky, podľa vinety najjednoduchších: oxidy v uhlíku, karbidy kovov, oxidy kyselín a soli. Všetky prejavy sa označujú ako neorganické.
Organických rečí je 27 miliónov – neorganických je viac, menej, tých pre najoptimistickejších pidrachunkov nie je 400 tisíc. Budeme hovoriť o dôvodoch rozvoja organických spór, ale väčšinou neexistuje dôvod na rýchle oddelenie dvoch skupín slov. Napríklad izokyanát amónny NH4NCO používajú neekologické produkty a sekcia (NH2) 2CO, čo je presne ten istý základný sklad N2H4CO, je organická.
Špecifikácie, ktoré môžu mať rovnaký molekulový vzorec, aj keď chemický, sa nazývajú izoméry.
Anorganická reč bola prijatá rozdelením na dva podtypy – jednoduchý a skladací (schéma 1). Jak už viete, hovoria tomu jednoduché slová, ktoré sa skladajú z atómov jedného veselý prvok, A skladanie - z dvoch alebo viacerých chemických prvkov.
Schéma 1
Klasifikácia neorganických rečí
Zdavalosya b, počet jednoduchých rečí je vinný rátaním s počtom chemických prvkov. Nie je to však tak. Vpravo v tom môžu atómy toho istého chemického prvku vytvoriť nie jedno, ale niekoľko jednoduchých slov. Tento jav, ako viete, sa nazýva alotropia. Príčinami alotropie môže byť počet atómov v molekule (napríklad alotropické modifikácie kyslého prvku - kyslíka a ozónu O3), ako aj rast kryštálovej mriežky pevnej reči (napríklad vieme aj o alotropia grafitu)
V type jednoduchej reči vidia kov, nekovy a vzácne plyny a zvyšok sa často označuje ako nekovy. Základom takejto klasifikácie je sila jednoduchých rečí, obohatenie atómov púčika o chemické prvky, z ktorých sú reči schválené, a typ kryštálovej mriežky. Všetky druhy vecí si mysleli, že vedú elektrické brnkanie, tepelnú vodivosť, plasty, volodymy kovovú bublinu. Nekovy spravidla nemajú takú silu. Naša hanblivosť „spravidla“ nie je vipadkova, ale ešte raz platnosť klasifikácie jednoduchých slov. Nekovy hádzali za úrady (napríklad alotropná modifikácia cínu - sivý cín - prášok šedej farby, nevykonávajte elektrický prúd, aby sa znížilo oslnenie і plasticita, teda ako žlčový cín, іnsha je typ alotropnej modifikácie. Pre kov sú charakteristické Navpaki, nekovový grafit, alotropná modifikácia v uhlí, velmy elektrické vodiče a volodya.
sám out-of-the-box klasifikácia skladacie anorganické prejavy, dobrá znalosť kurzu chémie na základnej škole. Tu vidíte spoluok triedy chotiri: oxidy, potraviny, kyseliny a soli.
Malo by sa to uskutočniť v triede pre neorganické prejavy v sklade, ktorý by sa mal vo vlastnom dome dostať do moci krajiny. Nagadaєmo označenie zástupcov triedy kože.
oxidy
- skladacia reč, ktorá je uložená v dvoch prvkoch, jeden z nich - kyselina v oxidačnom stupni -2 (napríklad H2O, CO2, CuO).
Pidstavi
- reťaz skladacích slov, ktoré sú uložené z atómu kovu a jednej alebo dvoch hydroxylových skupín (napríklad NaOH, Ca (OH) 2).
kyselina
- reťaz skladacej reči, ktorá je uložená vo vode a prebytkoch kyselín (napríklad HCl, HNO3, H2SO4, H3PO4).
soľ
- veľa skladacích slov, ktoré sú uložené z atómov kovov a prebytkov kyselín (napríklad NaNO3, K2SO4, AlCl3).
V závislosti od klasifikácie a označenia, takže možno pridať. Podľa prvého môžu úlohu kovu v potravinách a soli zohrávať skladacie časti pre známe katión amoniaku NH4 +, takže je možné skladovať iba nekovové prvky. Iným spôsobom je potrebné dosiahnuť číselnú skupinu prejavov, ako sú formálne znaky (za skladom) є úradmi a pre úrady sa odvolávať na amfotérne hydroxidy, aby sa pripustili úrady pre kyseliny. Napríklad hydroxid hlinitý Al (OH) 3 sa pri interakcii s kyselinou vyskytuje takto:
Al(OH)3 + 3HCl = AlCl3 + 3H20,
a pri raftingu na lúkach sa kyslosť prejavuje:
H3AlO3 + NaOH = NaAl02 + H2O.
Po tretie, klasifikácia skladacích anorganických rečí nie je spotrebovaná na pohľad skvelé číslo z'udnan, nakoľko nie je možné ich priviesť do niektorej z prepoistených tried. Tse, napríklad, z'udnannya, nastaviť dva alebo viac nekovových prvkov (chlorid fosforu (V) PCl5, sírouhlík CS2, fosgén COCl2).
? 1. Nazývajú sa prejavy anorganické a čo sú organické? Vznášať zadok. Poskytnite platnosť takýchto klasifikácií prejavov.
2. Ktoré slová sa nazývajú jednoduché a ktoré sú skladacie? Prečo počet jednoduchých slov mení počet chemických prvkov?
3. Jakova klasifikácia jednoduchých slov? Umiestnite zadky typu pokožky. Vzácne plyny є slová atómových alebo molekulárnych budov? Viesť argumenty k banálnym z týchto a іnshoї uhlov pohľadu.
4. Nazývajú sa anorganické slová oxidy, zásady, kyseliny, soli? Usmerňujte slová triedy kože, ilustrujte silu dvoch alebo troch rovnakých chemických reakcií.
5. Pre ďalšiu výhodu chemických reakcií upozornite na to, že amfotérne hydroxidy vykazujú silu kyselín aj zásad.
6. Uhličitan vápenatý (kreida, marmur, vapnyak) nadikhav sochárov, umelcov, básnikov. napríklad:
Téma: Reflexia odovzdaného materiálu
Lekcia: Klasifikácia anorganických rečí
V dejinách rozvoja vedy o chémii nové klasifikácie reč. Jedným z prvých znakov klasifikácie prejavov je odmietnutie buv dzherelo їkh. Pre veľkú znalosť reči prešli na roslinna (otriman z roslin), tvory (otriman z tvarin) a minerál (otriman z minineral).
J.Ya. Bercelius bol zjednotený v prejavoch, videných z roslínu a tvarina, do skupiny organických a táto skupina sa nazývala anorganické reči. Existuje viac ako jedna klasifikácia slov: podľa mlyna na kamenivo, podľa farby, podľa vône a podľa znakov.
Pre nás je dôležité systematizovať prejavy podľa ich charakteristiky drzé úrady, Yaki viznachayutsya їkh sklad. Celkovo je založená moderná klasifikácia anorganických rečí.
Jednou z prvých odrážok je klasifikácia rečových riadkov naraz a skladanie stavaním pred skladaním. Len čo reč šla do priestoru, bola privedená do záhybu, keďže reč nešla do priestoru pre žiadne mysle – niekedy až do prostého.
Nadal sa postavil, takže budova bola pred distribúciou zviazaná skladom reči. Jednoduché slová sú uložené z jedného chemického prvku a skladanie - z decilov.
Jednoduché slová sa spravidla delia na dve triedy: hádzali a nekovy. Pre kovy napr Fyzická sila, Yak metal blisk, visoka tepelná a elektrická vodivosť, plasticita. Sila neziskoviek skončiť s rozdielom, aj keď spravidla smradom kriku a špinou elektrikárov.
Malý. 1. Klasifikácia jednoduchých slov
Klasifikácia skladacej reči je viac skladacia. Voľbu triedy skladacej reči môžete vidieť v nánosoch zo skladu a mocností: oxidy, potraviny, kyseliny a soli.
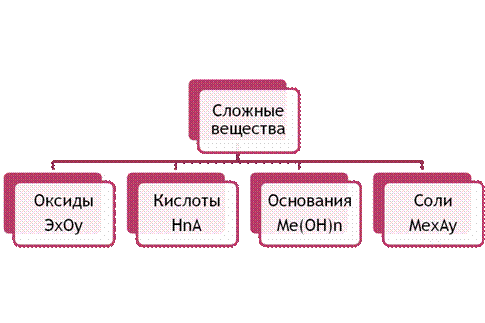
Malý. 2. Klasifikácia skladacej reči
Oxidy sa nazývajú binárne slová pred skladom, ktorý zahŕňa bozk. Počiatočný vzorec oxidov možno zapísať takto: E x O y. Kovy sa používajú na vytvorenie zásaditých oxidov a nekovy sú kyslé.
Hovoríme tomu skladacia reč, ktorá je uložená v kovových a jednej alebo aj decilových hydroxylových skupinách. Počiatočný vzorec je p_dstav Me (OH) n. Je nevyhnutné chodiť po lúke (mimo vody) a nie nekontrolovateľne pri vode.
Kyseliny sa nazývajú skladacie slová, ktoré sa ukladajú z atómov vo vode, budovy sú nahradené kovom a prebytky kyselín. Їx počiatočný vzorec môže byť napísaný v nasledujúcom poradí - H n A, de A - prebytok kyseliny.
Kyselina pre jeden znak klasifikácie - prejav v zásobárni molekúl atómov v kyslom - prechádzajú do kyslého a bezkyselinového. Kisnevmіsnі kyseliny a odovzdanie spojiť v skupine slov pod názvom hydroxyd.
Soli sa nazývajú skladacie slová, ktoré sa skladujú pre prebytky kovov a kyselín. Počiatočný vzorec je Me x A y.
Ale klasifikácia neorganických rečí má ďaleko od dokonalosti. Napríklad, do ktorej triedy by sa mali zaradiť údaje do chemického vzorca NH 3 (amiak)? Oxid je tiež suchý, pretože nie je možné priviesť ho ani do kyslého, ani do zásaditého stavu. Napríklad N 2 O, NO, CO sa nazývajú nesoľné (oxidy baiduzhimy).
1. Zbirnik zabdan і vpravo od chémie: 8. ročník: po Navchan. P.A. Oržekovskij aj. "Khimiya. 8. trieda “/ P.A. Orzhekovskiy, N.A. Titov, F.F. Hegel. - M.: AST: Astrel, 2006. (s. 117-123)
2. Ushakova O.V. Pracujúci človek seje z chémie: 8. ročník: pred asistentom P.A. Oržekovskij aj. "Khimiya. 8. trieda „/ O.V. Ushakova, P.I. Bespalov, P.A. Oržekovskij; vyd. Prednášal prof. P.A. Oržekovskij - M.: AST: Astrel: Profizdat, 2006. (S. 120-123)
3. Chémia. 8 trieda. Učebnica pre zahraničné vzdelávanie. ustanovka / P.A. Oržekovskij, L.M. Meshcheryakova, M.M. Šalašovej. - M .: Astrel, 2013. (§36)
4. Chémia: 8. trieda: Učebnica pre zahraničné vzdelávanie. ustanovka / P.A. Oržekovskij, L.M. Meshcheryakova, L.S. Pontak. M.: AST: Astrel, 2005. (§42)
5. Encyklopédia pre deti. Zväzok 17. Хімія / Chief ed. V.A. Volodin, viedol. vedecký. vyd. І. Leenson. - M.: Avanta +, 2003.
Dodatkovі webové zdroje
2. Informácie o chémii na leme ().
Domov zavdannya
1. c. 122-123 č. 2,3 4 od Pracovná zoshita z chémie: 8. ročník: pred asistentom P.A. Oržekovskij aj. "Khimiya. 8. trieda „/ O.V. Ushakova, P.I. Bespalov, P.A. Oržekovskij; vyd. Prednášal prof. P.A. Oržekovskij - M.: AST: Astrel: Profizdat, 2006.
2. str.201 č. 1,3 od asistenta P.A. Oržekovskij, L.M. Meshcheryakova, M.M. Shalashova "Khimiya: 8kl.", 2013 s