Všeobecné charakteristiky prvkov IV skupiny vedúcej skupiny
obecný zahraničná hypotéka„Lycei č. 43“ zo Saransku
Mať  čitateľ chémie: Sismanova N.Yu.
čitateľ chémie: Sismanova N.Yu.
Médiá - lekcia na témy
« Zagalna charakteristika prvok IV A skupina. Vuglety “.
Meta lekcia
: Charakterizujte prvky skupiny IV A, ukážte alotropiu druhu v uhlí, atóm púčika a Veselé úrady, Rozumieme „adsorpcii“.
Zariadenie a činidlá:
úvodná elektronická kniha „Zagalna a anorganická chémia“ (laboratórium multimediálnych systémov MarSTU), „vuglety“, modrý lakmus, žiadne wugilské predlohy, drzé sklo, paprylka palichka, lievik, fialka
Typ lekcie
: Vysvetlenie nového materiálu.
Lekcia jedla: ( zaznamenané v dávkach) :
2. Uhlík. Allotropia v uhlí.
3. Budova o atóme a chemickej sile v uhlí.
4. Adsorpcia.
5. Zaseknutý v uhlí.
6. Obeh v uhlí v prírode.
Choď na hodinu
učiteľ: Všetko najlepšie k narodeninám vám môže ponúknuť 4 skupiny hlavná skupina periodické systémy. Pomôžte nám s počítačom. Buďte vinní z úctivého počúvania, premýšľania a zapisovania, pre ktorých s vami prediskutujeme celú výživu hodiny.
I. Kontrola disku (s krátka poznámka sily a budovy a atóm v uhlí).
1. Všeobecné charakteristiky prvkov skupiny IVA.
1) Skupina Elementi IVA, їх klasifikácia na kovy a nekovy.
2) Znalosť prírody.
3) Elektronický rozpočet atómov, podobnosť a viditeľnosť.
4) Možné stupne oxidovaných prvkov.
5-6) Múdrosť autorít podľa skupín je od uhlia k olovu.
7) Oxidové prvky, stх.
8) Vodnevі z'єdnannya elements, їkh budova and znhozhennya in nature.
Potraviny na fixáciu:
Čo je zvláštne pre prvky skupiny v Budovia Atom a aký je rozdiel?
Ako môžeme zmeniť silu prvkov z uhlia na olovo?
Yaku kroky oxidovaného zápachu v oxidoch a vodnatých spolu?
2. Vuglety. Allotropia v uhlí.
1-2) Znalosť uhlia v prírode a prejav alotropie.
3) Diamond, yogo budova, moc, držba a držba
4) Grafit, yogo budova, moc, posadnutosť a zasosuvannya.
5) Karbin, yogo budova, moc, posadnutosť.
6) Polikomulen, yogo budova, moc.
7) Fullerene, yogo budova.
Potraviny na fixáciu:
Vedeli ste o alotropických druhoch uhlia?
Ako môžete prejsť z jedného druhu na druhý?
Chi є dedina a kam'yane vugіlla alotropic s hadmi v uhlí?
Myslíte si, prečo sú štýly bohatých alotropických modifikácií v uhlí? (Myšlienka byť schopný čítať výživu, ktorá je známa z atómu púčika v uhlíku).
3. Budova o atóme a chemickej sile v uhlí.
8) Elektronický a grafický vzorec atómu v uhlíku.
9) Májové stupne oxidácie v uhlíku
10-13) Chémia energie v uhlí (interakcia s kovmi, nekovmi, oxidmi).
14) Interakcia so silnými oxidačnými činidlami (napísanie príkladu reakcií špecifických pre oxidáciu a nastavenie výkonu metódou elektronickej váhy).
15) Zapojenie uhlia s vodou. Stagnácia danej reakcie.
Potraviny na fixáciu:
Aký nevinný atóm prejde na uhlie?
Ako silné je to ukázať v uhlí pri interakcii s kovmi a nekovmi?
Yaka oxidované kroky v karbidoch?
Čo je možné použiť na uhlík z ich oxidov kov a nekov?
Akú úlohu hrá v priemyselnom stave reakcia uhlia s vodou?
Aké aktíva nemusia byť uviaznuté v lekárstve a protogase?
II. Laboratórny robot.
4. Adsorpčný proces prenasledovania povrchu pevné telo ridini(Cez poréznu budovi tila). Ukážte jav tse napomenutím.
DOSVID: Do konca modrého lakmusa na spresnenie majetku vugilly. Vidfіltruvati otrimanu sumіsh. Filtrat je úplne bystrý.
III... Robot za stolmi psovoda.(O.S. Gabrielian. Khimiya 9. trieda s.131, s.133)
5. Zaseknutý v uhlí.(Pozrite sa na tabuľku psovoda a regiónu v oblasti spotreby uhlia: vugilla, grafit, sadze).
6. Obeh v uhlí v prírode.(Pozrite sa na tabuľku psovoda a z'yasuvati, pretože procesy v prírode prebiehajú pre časť uhlia: gnitta, putovanie, dichannya, gnittya, fotosyntéza).
IV. Zakrіpennya vivcheny.
Výkon Razstavte metódou elektronického vyváženia na úroveň vpravo č. 8 s.134.
Hlavné charakteristiky štvrtej skupiny hlavnej pidskupiny:
- a) sila prvkov z hľadiska budov a atómu;
- b) oxidačný stupeň;
- c) sila oxidov;
- d) sila hydroxidov;
- e) vodné cesty.
a) Vugety (C), kremík (Si), germánium (Ge), cín (Sn), olovo (Pb) - prvky 4 skupín hlavnej pidskupiny PSE. Na najobľúbenejšej elektronickej guľôčke atómov sú 4 elektróny: ns 2 np 2. Pri raste sériového čísla prvku rastie atómový polomer, nekovová sila slabne a kov sa plní: uhlie, nemčina
b) Prvky cyklu skupiny vykazujú pozitívne aj negatívne úrovne oxidácie: -4, +2, +4.
c) Oxidy Vishі v uhlíku a kremíku (C0 2, Si0 2) môžu byť kyslé, oxidy iných prvkov skupiny - amfoterné (Ge0 2, Sn0 2, Pb0 2).
d) Vugilna a kyselina kremičitá (H 2 CO 3, H 2 SiO 3) - slabá kyselina. Hydroxid germánium, cín a olovo amfoterium sú slabo kyslé a zásadité: H 2 GeO 3 = Ge (OH) 4, H2 SnO 3 = Sn (OH) 4, H2 PbO 3 = Pb (OH) 4.
e) Vodnevі spoluki:
CH4; SiH 4, GeH 4. SnH 4, PbH 4. Metán - CH 4 - mitsne z'єdnannya, silan SiH 4 - mensh mitsne z'єdnannya.
Schémy vývoja atómov v uhlíku a kremíku, napríklad v moci.
З lS 2 2S 2 2p 2;
Si 1S 2 2S 2 2P 6 3S 2 3p 2.
Uhlík a kremík sú nekovové, pretože na najnovšej elektronickej guličke sú 4 elektróny. Ak je kremík menší ako polomer atómu, je typickejší pre novú elektroniku, ale nie pre uhlík. Vuglety - olovo:
Zavdannya. Ako priniesť, ako je grafit a diamant lot alotropický z hľadiska jedného a toho istého chemického prvku? Kto môže vysvetliť názory úradov?
Rozhodnutie. І diamant, a grafit, keď sú zapálené v kyslom prostredí, nastavte oxid na uhlík (IV) C0 2, keď prechádza vodou, vipadє bilium sediment uhličitan vápenatý CaCO 3
Z + 02 = C02; C0 2 + Ca (OH) 2 = CaCO 3 v - H 2 O.
Okrem toho je možné diamant brúsiť z grafitu, ak je zahrievaný vo vysokom zveráku. Od toho istého času až do skladu a grafitu a diamantu sú zahrnuté iba v uhlí. Rozdiel v sile grafitu a diamantu je vysvetlený rozdielom v kryštálovej mriežke.
V kryštálových roztokoch je diamant atómom kože v uhlíku výboja od spoločnosti. Atómy roztasvanі na tom istom vіdstanі jeden z jedného a ešte viac jemne spojené dohromady s kovalentnými väzbami. Tsim vysvetlí veľkú tvrdosť diamantu.
Grafit má atómy v uhlíku s rovnobežnými guličkami. Prejdite medzi zavesené gule vo väčšom meradle, nižšie medzi zavesené atómy v guli. K zvuku medzi loptičkami dodám na malosti zvuku a grafit sa dá ľahko rozdeliť na tenké kúsky, ktoré sú ešte mikroskopickejšie.
Z'єdnannya z vodnem, ladenie scho na drevenom uhlí. Empirické vzorce, typ hybridizácie atómov v uhlíku, valencia a stupne oxidácie prvku pokožky.


Stupeň oxidácie je vo väčšine prípadov +1.
Valencia cesty je jedna, valencia uhlia je jedna s druhou.
Vzorce silných a kremičitých kyselín, chemickej sily z hľadiska redukcie na kovy, oxidy, pstav, špecifická sila.
H 2 CO 3 - kyselina vugilová,
H 2 SiO 3 - kyselina kremičitá.
H 2 CO 3 - je to v rozmedzí:
H2C03 = H20 + C02
Si 2 SiO 3 je pevná rieka, vo vode prakticky nehanebná, a preto sa vodné katióny vo vode prakticky neodštiepia. V spojení s cymom je tiež silná kyselina, pokiaľ ide o indikátor, H 2 SiO 3 nemôže byť ovplyvnený, je ešte slabší ako silná kyselina.
Si 2 SiO 3 - netriviálna kyselina; pri zahrievaní sa postupne rozširuje:
H2Si03 = Si02 + H20.
Н 2 CO 3 reaguje s kovmi, oxidmi kovov, pododdelenia:
a) H2CO3 + Mg = MgCO3 + H2
b) H2CO3 + CaO = CaCO3 + H20
c) H2CO3 + 2NaOH = Na2C03 + 2H20
Chemická sila kyseliny uhličitej:
- 1) alkoholické kyseliny,
- 2) špecifický výkon.
Dôkaz na potvrdenie oprávnených reakcií.
1) reakcia s aktívnymi kovmi:

Zavdannya. Vo zvyšku chémie je rekonštitúcia súčtu oxidu kremíka (IV), uhličitanu vápenatého a média, posledných zložiek súčtu. Popíšte koniec dňa.
Rozhodnutie.
1) k úplnému spěchu kyseliny chlorovodíkovej.
plán lekcie
Počiatočné charakteristiky prvkov skupiny IV A.
Uhlík a kremík
meta:
pokrytie: formulovať v štipendiách dvorček o prvkoch, ktoré majú vstúpiť do skladu 4 - skupina, vivchita hlavnej sily, dbajte na biochemickú úlohu a skladovanie hlavných prvkov dňa.
vývoj: rozvíjať tipy pre písanie a písanie, správy, správy, znalosti vikoristovuvati otrimanі pre nové podniky.
vihovuє: vikhovati takmer spotrebovať nové znalosti.
Choď na hodinu
Opakovanie prejdených:
Koľko prvkov sa používa pred nekovmi? Chcete, aby to bolo v PSKHE?
Aké sú prvky organogénneho obsahu?
Predstavte modulárny mlyn na všetky nekovy.
Aké sú molekuly nekovov?
Hovorí sa oxidom, že netvoria soli? Napíšte vzorce pre nesůl tvoriace oxidy nekovov.
Cl 2 → HCl → CuCl 2 → ZnCl 2 → AgCl
Zostávajúca rivnyannya reakcia je zaznamenaná v iónovej viglyade.
Pridajte nasledujúce možné reakcie:
1) H2 + Cl2 = 6) CuO + H2 =
2) Fe + Cl2 = 7) KBr + I2 =
3) NaCl + Br2 = 8) Al + I2 =
4) Br2 + KI = 9) F2 + H20 =
5) Ca + H2 = 10) Si02 + HF =
Zaznamenajte rovnaké reakcie výmeny dusíka za a) vápnik; b) s vodou; c) kyslé.
Transformácia Zd_ysniti lantsyuzhok:
N 2 → Li 3 N → NH3 → NO → NO 2 → HNO 3
Keď sa podľa reakcie distribuovalo 192 g dusitanu amónneho, pridalo sa 60 litrov dusíka. Poznať spôsob výrobku je teoreticky možné.
Vivchennya nový materiál.
Až do 4 A skupiny obsahuje p-prvky: uhlík, kremík, germánium, cín a olovo. Na základe počtu energetických rás môžu byť atómy bez energie na novej úrovni pre 4 elektróny. V súvislosti s nárastom skupiny zhora nadol počet uložených elektronických guličiek a veľkosť atómu. Proteín v uhlíku a kremíku je často odvodený od sily všetkých prvkov. Všetky druhy nekovov. Germánium má kovové nápisy a cín a olovo páchnu nad nekovovými.
V prírode na drevenom uhlí Staňte sa diamantom a grafitom vo vilnom tábore. Zm_st v uhlí v zemskej kôre sa blíži k 0,1%. Vin vstúpiť do skladu prírodných uhličitanov: vapnyak, marmur, kreydy, magnezit, dolomit. Vuglety, hlava skladová časť organická reč. Vugillu, rašelinu, benzín, drevo a zemný plyn možno vnímať ako palivo, ktoré v ohni stagnuje.
Fyzická sila. Vuglets yak je jednoduché slovo v kruhu alotropických foriem: diamant, grafit, karabína a fullerén, ktoré je možné rýchlo vyvinúť Fyzická sila, Vysvetlím sa púčikom kryštálových mriežok. Carbin - jemný kryštalický prášok čiernej farby, prvýkrát syntetizovaný v 60-tych rokoch chemikmi z Radianska, kvôli poznaniu prírody. Po zahriatí na 2 800 ° bez prístupu z neho urobte grafit. Fullerene - v 80 -tych rokoch gule syntetizovali sférické štruktúry stanovené atómami uhlíka a pomenovali ich fullerény. Smrad je uzavretá štruktúra, ktorá pozostáva z jednotného počtu atómov v uhlí - Z 60, Z 70.
Veselé úrady. V chemicky zmiešanom uhlí s rozumné mysle inertný. Rýchlosť odozvy sa prispôsobí nastavenej teplote. Pri vysokých teplotách sa uhlie mieša s vodou, kyselinou, dusíkom, halogénmi, vodou a niektorými kovmi a kyselinami.
Ak stávka na vodu prejde vougillami, od koksu by sa malo upustiť množstvo oxidu v hrubom (II) a vodníku:
C. + H 2 O = CO + H 2 (para),
Reakcia prebieha pri 1200 ° C, pri teplotách pod 1000 ° C, oxiduje sa CO 2 :
З + 2H 2 O= CO 2 + 2 H 2 .
Promislovo dôležitý proces є premena vodného plynu na metanol (metylalkohol):
CO + 2H 2 = CH 3 ВІН
Pri vysokých teplotách vstrekovaných do uhoľnej budovy s kovmi, karbid, uprostred nich vidia „metán“ a „acetylén“;
Sas 2 + HCl = CaCl 2 + C. 2 H 2
Al 4 C. 3 + 12 H 2 O = 2 Al(Oh) 3 ↓ + 3 CH 4
Veľkou praktickou hodnotou je karbid vápenatý, ktorý je možné použiť na ohrev výparov CaO a koksu v elektrických peciach bez prístupu k jedlu:
CaO + 3C = Sac 2 + CO
Vikrist karbidu vápenatého na odmietnutie acetylénu:
Sas 2 + 2 H 2 O= Ca (OH) 2 + C. 2 H 2
Pre uhlie sú však charakteristické reakcie, v ktorých vína ukazujú novú silu:
2 ZnO + C. = Zn+ CO 2
C.Konsolidácia v uhlí.
Oxid uhličitý (CO) je špinavý plyn. Na priemyselnej úrovni je potrebné zlikvidovať priechody oxidom uhličitým počas pečenia vugіllas na vysoká teplota... V laboratórnych umývadlách môže CO pri zahrievaní vydávať koncentráciu kyseliny sírovej a egreša (kyselina sírová je voda):
NSOOH =H 2 O+ CO
Oxid v uhlíku (CO 2) - plynný oxid uhličitý. V atmosfére oxidu uhličitého je málo 0,03% hmotnosti alebo 0,04% hmotnosti. Preneste sa do atmosféry sopky a horúcej dzherely a, ako náhle ľudia začnú páliť, spália horľavé kopaliny. Atmosféra celú hodinu vymieňala plyny s oceánskou vodou, ako keby pomstila 60 -krát viac oxidu uhličitého a menej atmosféry. Zdá sa, že plynný oxid uhličitý je dobrý na ospalé promenády v infračervenej oblasti spektra. Tim sám vypne plynný oxid uhličitýє skleníkový efekt a regulovať globálnu teplotu.
V laboratórnych umývadlách sa plynný oxid uhličitý premýva kyselinou chlorovodíkovou na marmur:
CaCO 3 + 2 HCl = CaCl 2 + H 2 O+ CO 2
Sila oxidu uhličitého nevedie k vzniku požiarov v iných prílohách. Keď je úchop posunutý, rozdiel v kysličníku uhličitom prudko rastie. Celkovo by mal byť základný náter odobratý z šumivých nápojov.
Kyselina vugilová je v roztoku nežiaduca. Pri zahrievaní sa rozdiel ukladá na oxid v uhlíku a vode. Soli kyseliny sú tuhé, ak je samotná kyselina nestála.
Najvazhliyu reakcia na uhličitan - iónové є riedenie minerálnych kyselín - chlorovodíková alebo sirchanoi. Pri mnohých tŕňoch sú žiarovky viditeľné v kysličníku uhličitom a pri prechode roztokom sa v dôsledku potvrdenia uhličitanu vápenatého zakalí hydroxid vápenatý (voda).
Kremík. Písanie najobľúbenejšieho prvku na Zemi. Vin sa stáva 25,7% hmotnosti pozemských osýpok. Významnú časť predstavuje oxid kremičitý, tzv oxid kremičitý„Yaky byť videný pri pohľade na zjazdovku alebo kremeň. Pri veľmi čistej viglyade rastie oxid kremičitý v viglyadovom mineráli, tzv dievčenský kryshtal. Kryštalický oxid kremičitý, tvorený malými domčekmi, vyrobený z drahých kameňov: achát, ametyst, jaspis. Іnsha skupina prírodných produktov na výrobu silikati silikati - stratená kyselina kremičitá.
V prípade priemyselného oxidu kremičitého sa spracováva koksom v elektrických peciach na nový oxid kremičitý:
SiO 2 + 2 C. = Si + 2 CO
V laboratóriách je ako kapacita predchodcov horčík alebo hliník:
SiO 2 + 2 Mg = Si + 2 MgO
3 SiO 2 + 4Al = Si + 2Al 2 O 3 .
Väčšina čistého kremíka sa získava redukciou chloridu kremičitého parami zinku:
SiCl 4 + 2 Zn = Si + 2 ZnCl 2
Fyzická sila. Kryštalický kremík je kryhke tmavosivej farby s oceľovým plameňom. Štruktúra kremíka je podobná diamantu. Silikónový vicorist v kvalite sprievodcu. Sme takzvaní batérie na spanie Zdatnі znova transformuje energiu svіtlovu na elektrickú energiu. Silikátový kremík v metalurgii na odstraňovanie kremičitých ocelí, ktorý má vysokú tepelnú odolnosť a odolnosť voči kyselinám.
Veselé úrady. Za chemickými silami kremíka, podobne ako v uhlí, є nekovových alebo dokonca nekovových, sa pohybuje slabšie, takže hodnota atómového polomeru je väčšia.
Silikón s extravagantnou mysľou je elegantný na to, aby skončil s energiou. Bezposeredno v vzamodіє iba s fluórom, spájajúce fluorid s kremíkom:
Si + 2 F 2 = SiF 4
Kyseliny (okrem súčtu fluorovodíkového fluorovodíka a dusičnanu) nejdú na kremík. Ale vin raschinyaєtsya v hydroxidových kovoch:
Si + NaOH + H 2 O = Na 2 SiO 3 + 2H 2
Pri vysokých teplotách v elektrickej peci, pri súčte potravín a koksu, použite karbid kremíka SiC- karborundum:
SiO 2 + 2C =SiC+ CO 2
Brúsne kamene a brúsne kruhy sú vyrobené z karbidu kremíka.
Spoluky kovov s kremíkom sa nazývajú silicid:
Si + 2 Mg = Mg 2 Si
Pri použití silicidu s kyselinou chlorovodíkovou horečnatou použite najjednoduchší roztok kremíka silán -SiH 4 :
Mg 2 Si+ 4nsl = 2 MdCl 2 + SiH 4
Silan je útočný plyn s neprijateľným zápachom, ktorý sa ráno samovznietí.
Z'єdnannya pazúrik. Oxid kremičitý- pevná žiaruvzdorná rieka. V prírode rozšírenia v dvoch formách kryštalický a amorfný oxid kremičitý. Kyselina kremičitá- є slabá kyselina, po zahriatí sa ľahko nanáša na vodu a oxid kremičitý. Môžete byť tiež otrimana yak pri viglyadi želé podobnej hmoty, pomstiť sa vode, ako aj pri viglyadi koloidného roschu (sol). Soli kyseliny kremičitej zavolaj sa silikatami. Prirodzená sila - aby ste sa dostali k skladacím spolukom, zo skladu môžete vidieť obrázok v dôsledku oxidov decile. Tilki silikati soda and kalórií vo vode. Namex meno s hojdacím svahom, a differencesх rozdielov - vzácny svah.
Zavdannya pre zakr_plennya.
2. Ak chcete pridať motív rovnakých reakcií, dokončite úlohu.
| 1 tím
| 2 tím
| 3 tím
|
| H 2 SO 4 + HCl - | CaCO 3+? -? + C02 + H20 |
|
| NaOH + H 2 SO 4 - | CaCO 3 + H 2 SO 4 - | K 2 SO 4 + CO 2 + H 2 O - |
| CaCl 2 + Na 2 Si O 3 - |
||
| Si O 2 + H 2 SO 4 - | ||
| Ca 2+ + CO 3 -2 - | CaCl 2 ++ NaOH - |
|
| zavdannya: Keď sa oxid (111) zaviedol do uhlia, odstránilo sa 10,08 g zlata, čím sa stratilo 90% teoreticky možného výťažku. Jaková hmotnosť je prevedená na oxid zaliz (III)? | zavdannya: Koľko treba na silikat sodný, keď je legovaný oxidom kremičitým zo 64,2 kg sodíka, prečo by malo byť odstránených 5% domu? | zavdannya: Kyselinou chlorovodíkovou na 50 g uhličitanu vápenatého sa odoberie 20 g oxidu uhličitého (IV). Aký druh oxidu v uhlíku (IV) (v%) je teoreticky machový? |
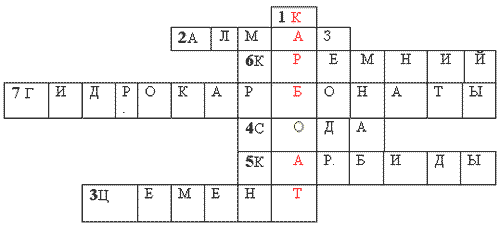
Krížovka.
NSasi vertikálne: 1. Sila kyseliny uhličitej.
Horizontálne: 1. Najpevnejšia prirodzená reč na Zemi. 2. Vzdelávací materiál. 3. Rechovina, jak bude uložený na prípravu testu. 4. Z'єdnannya kremík s kovmi. 5. Prvok hlavnej pidskupiny 1V skupina PS chemické prvky... 6. Soli kyseliny uhličitej, ktorá pomáha pomstiť vodu. 7. Prirodzene z'єdnannya kremík.
Domáca úloha: strana 210 - 229.
Téma:Počiatočné charakteristiky prvkov skupiny IV-A.
Sila.
meta : Pozrite sa na charakteristiku skupiny prvkov IV-A na zadku v uhlí a kremíku; fyzikálna a chemická sila týchto prvkov, čo znamená „absorpciu“.
osvetlenie : prečítajte si vedci nezávisle zdobuvati znalosti racionálna vikorystannyaіznіh dzherel іnformatsії (handlers, science-popular literature) і zastosovuvati іtrimanі knowledge; Vytvorte príčinné - dedičné spojenie medzi ľuďmi z Budvy, úradmi a zákonmi reči na základe teórií vzdelávania, publicity a systematizácie znalostí vedcov o uhlíku a kremíku v histórii ľudí;
Rozvíja sa : rozvoj vzdelávacieho záujmu školákov v mysli vidieť hlavu, dostať ju von, používať ju, logické myslenie;
vikhovuvati zdravé správanie v triede.
ustatkuvannya: Počítač, prezentácia, obsluha, tabuľka „Periodický systém chemických prvkov“
Ísť na lekciu:
1. Organizačný moment.
2. Skontrolujte domácu úlohu.
3.Aktualizácia základných znalostí
(Frontal besіda).
Pomenujte položky, ktoré chcete zadať predtýmIVskupina.
Pomenujte položky podľa skupiny pidgroupIVskupinka.
4. Štúdium nového materiálu.
Poloha v periodických systémoch chemických prvkov, budova atómu C,Si
učiteľ ... Ahoj, čudujme sa periodický systém chemické prvky a je dôležité, aby tieto prvky zahŕňaliJaV-A pidgroup?
Vidpovid učenec.
Na čele skupinyJaV-A gr. Zadávanie položiek:C., Si, Ge, Sn, Pb-
C, Si, Ge - nekovy - Sn, Pb - kovy
učiteľ ... Čo spіlnogo v Budovі atomsіv cikh prvky?
( učenie robota dieťaťom )
1. Vuglety
6 C) 2) 4
…2 s22 p2
2. Silikón
14 Si) 2) 8) 4
…3 s23 p2
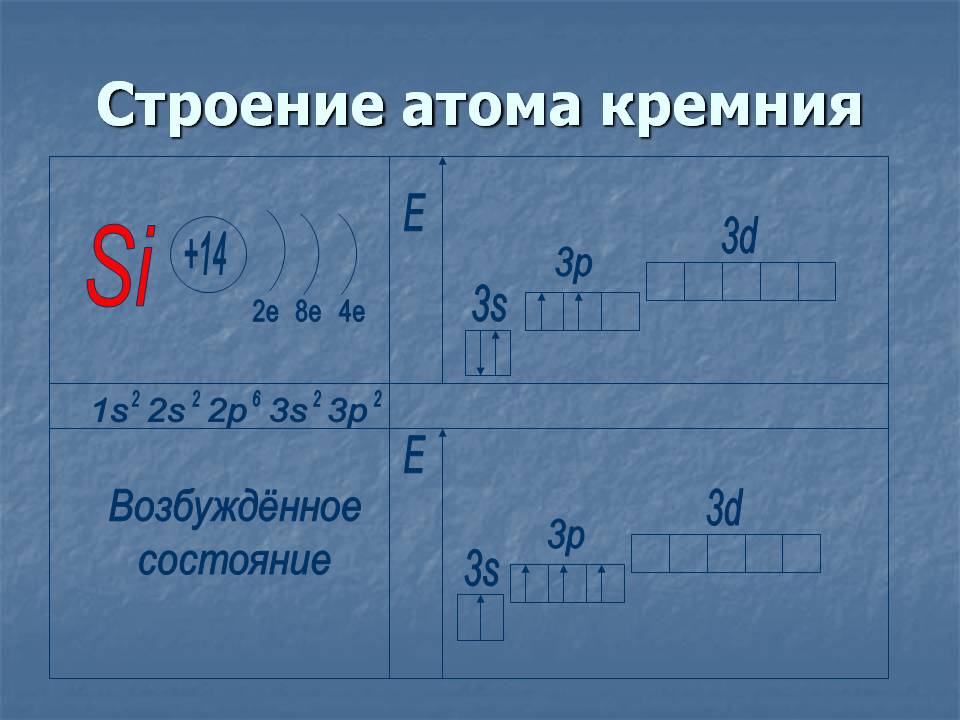
hodnotený učencom ... Nech rovnaký atóm budovu (na poslednom rіvnі 4e).ns 2 np 2 a valenciaII, IV
Učiteľ. Ako vzdorujete sile prvkov od veľkých?
hodnotený učencom ... Rast kovovej sily rastie v raste kovu, ale zmeny v nekovovej sile.
učiteľ ... Yaki vischі oxidy a schvaľovať prvky skupiny 1V-A?
hodnotený učencom ... Konfigurujte typ vischі oxidov -RO 2 ( robot uchnya bіlya doshki ) CO 2, SiO 2 Ge O 2 SnO 2 PbO 2
Učiteľ. Yak lietajúca voda spoluki nastaviť prvky?
Vidpovid učenec. Typ lietajúcej vodyRH 4 ( CH 4 , SiH 4 )
Učiteľ. Do uhlia nastavím 2 alotropické druhy: grafit, diamant
Tabuľka „Kryštálová mriežka Budova pre diamant a grafit“
alotropia v uhlíku
grafit
diamant
Fyzická sila
tmavošedá, vedie elektrický prúd a zahrieva sa
Prozore je kryštalická pevná reč s charakteristickým žmurknutím.
t = 1420 tavenie; nevádzajte elektrický prúd a teplo
Robot v skupinách s putami na rukách. Výmena informácií. Nahrajte na Zoshite.
Skupina č. 1 Skupina č. 2
Z
Si
znalosti v prírode
Trieda CaCO 3 marmurský diamant
grafit
malachit CuCO 3
ťažký benzín
27% pozemských osýpok - šťava SiO 2
Veselé úrady
C + 2H 2 → CH 4
C + O 2 → CO 2
3 C +4 AL → AL 4 C. 3
Ca + 2C → CaC 2
2 AL 2 O 3 + 3C → 4AL + 3CO 2
Si + O 2 → Si O 2
Si + 2CL 2 → SiCL 4
Si + 2Br 2 → SiBr 4
2Mg + Si → Mg 2 Si
sanie
vrtáky, sklorizi, brúsny prášok, drahé kamene,lekárske čistenie alkoholu od fuselových olejov
čistenie tsukru v rafinériách od rechovínov, ktoré produkujú youma zhovty kolir
na základe adsorpčnej sily drevenej vugily ruský chemik Mykola Dmitrovich Zelinsky rozbil filtračný plyn
(Ukážka filtračných boxov Budovi na Protigaz).
Poskytovateľ (batérie na spanie)
oceľ
budíček
Adsorpcia-– dobrá kvalita rozpoznávania plynu a rečina povrchu pevného tela ridini(Cez poréznu budovi tila).
Problém s výživou: Je adsorpcia fyzikálnym alebo chemickým procesom?
Ukážka pred „adsorpciou“.DOSVID: Do konca modrého lakmusa na spresnenie majetku vugilly. Vidfіltruvati otrimanu sumіsh. Filtrat je úplne bystrý.
VIDPOVID : fyzický, čo nemení sklad reči
5 Systematické a verejné znalosti
Zdieľať revíziu. Napíšte zhrnutie reakcie.
CH 4 ← C. → CO → CO 2 → H 2 CO 3
CaC 2
reflexia
Yak vi vvazhaєte, prečo je naša lekcia poskytovaná?
Chceli by ste vidieť návštevníka viackrát, ale hrali by ste to rovnako?
Videli ste pozitívne emócie z tohtoročnej hodiny?
6. D / s
Pred skladom skupiny je 5 prvkov: dva nekovy-uhlík a kremík, ktoré sa nachádzajú v druhom a treťom období mendelovského systému a 3 kovy-Nimechchin (medziprodukt medzi nekovmi a kovmi, cín a olovo v IV, VI. Pre všetky tieto prvky je charakteristické, že sto páchne na novej energetickej úrovni 4 elektrónov. Okrem toho je možné ukázať kroky oxidácie od +4 do -4. 4, PbН 4. pri zahrievaní vo všedný deň sa zbavte prvkov jedla, vody a halogénov.
Fáza oxidácie +4 zhasne, keď sa 1s-elektróny prenesú na vertikálny p-orbitál. S nárastom polomeru atómu sa zmení spojenie medzi vyzváňacími elektrónmi a jadrom. Nekovová sila sa zmení, ale kov bude rásť. (Teplota topenia a teplota varu atď. Klesá)
cín nenájdený na počet široko distribuovaných kovov (namiesto 0,04% v zemskej kôre), je celkom ľahké roztaviť sa z rúd, a to sa stalo SLNEČNÝMI ľuďmi v očiach zliatin od poludnia (bronz) od staroveku krát. Vidieť ho pri pohľade na kyslú spoluca SnO 2 (cínový kameň, z ktorého sa ide na ďalšiu aktualizáciu). Vo vinárskom mlyne je cín hodvábne béžový kov. S cínovou tyčinkou z cínu môžete cítiť charakteristické šklbanie roštov kryštálov jeden po druhom.
Cín je mäkký a viskózny a dá sa ľahko zvinúť na tenké pláty, ktoré sa nazývajú cínová fólia alebo stanil.
Krim zychany biely cín Kryštalizuje v tetragóne, ak je menším druhom cínu - otec cín Kryštalizujte v kubickom systéme a získate menší výkon. Viac cínu je stabilného pri teplotách vyšších ako 14 ° C a otcov - pri teplotách nižších ako 14 ° C, takže keď sa ochladí, cín sa zmení na otca. Na zv'yazyu zі zіnuyu znіnoy zmenіnuyu sіlnosti kovu, keď tsyomu rassypayetsya v sivom prášku. Tento jav budem nazývať cínový mor. Pre všetky transformácie bieleho cínu je lepšie, aby sa zahriali na teploty blízke 30 ° C; rýchlejšie v prítomnosti zárodkov kryštálov šedého cínu.
Zliatina cínu s povrchovou úpravou a nechajte zmraziť na prípravu ložísk. Fúzia Tsi (cínové babiti) volodyut vysokých medzivrstvových síl. Na spájkovanie sa široko používajú zliatiny cínu s olovom - pripіy. Yak legujúcej zložky cínu je zahrnutý v zliatinách midi. Pri izbovej teplote cín pri izbovej teplote neoxiduje, ale krok za krokom ho zahrieva na teplotu topenia, aby sa zmenil na oxid ciničitý. Na cín sa voda SnO2 nepoužíva. Zriedená kyselina chlorovodíková a kyselina sirchanová ešte viac. Koncentrovaná kyselina, keď je zahriata, rozdrobte plech.
Sn + 2 =Сl = SnСl 2 + Н 2 #
Sn + 4H2S04 = Sn (SO4) 2 + 2S02 # + 4H20
Koncentrovanejšia kyselina dusičná, intenzívnejšia reakcia
4Sn + 10 HNO3 = 4Sn (NO3) 2 + NH4NO3 + 3H20
Sn + 4 НNО 3 = Н 2 SnО 3 $ + 4NО 2 # + Н 2 О v koncentrácii
Koncentrované lúky reagujú Sn + 2NаОН = N a 2 SnО 2 + Н 2 #
Na 2 SnO 2 Staňte sa sodíkom. Na razchina soli hydratované (otocheni s molekulami vody). Na druhej strane plech prikryte vytvrdnutým plavkoy. Cínový komplex spoluca Nа 2
40% cínu sa nachádza vo výrobe plechoviek. Zalizo je potiahnutý cínom. Cín sa používa na nastavenie stiyki spolu s oxidačnými krokmi +2, +4.
SnО (II) -práškový prášok, po otvorení ísť
Oxid cínu sa nachádza v prírode. Potvrďte, keď ráno spíte Sn.
Kyselina cínová Н 2 SnО 3 je nerozpustná (bilium v prášku) v spojení s lúkami Н 2 SnО 3 + 2 NaOH + Н 2 О = N a 2
Chlorid cínu, pinky SnСl 2, hydrid cínu SnН 4, bezfarebný, dokonca aj odpadový plyn.
Viesť. Ruda. Čokoľvek je olovo odstránené, nazýva sa to blend olova.
PbS + 3О 2 = 2PbО + 2SО 2 - praženie.
Roztopiť PbO spolu s koksom, odstrániť olovo a potom ho vyčistiť.
Olovo je dôležitý kov. Víno je mäkké a jedzte nožom.
Olovo je v technológiách široko používané. Väčšina vitamínov je potrebná na prípravu plášťov káblov a plátov batérií. Olovo sa používa na prípravu munície a výstrelu. Vin vstúpiť do skladu zliatin bagatokh (ložiská, drukarsky font, spájka). Olovo je dobré g - viprominuvannya a vikoristovuyutsya na ich zachytenie pomocou robotov s rádioaktívnymi prejavmi.
Príležitostne je ľahko oxidovaný a pokrytý oxidovaným oxidom, ktorý je možné zozbierať v dôsledku oxidácie. Voda neruší olovo, ale skôr v prítomnosti zničujúceho nápoja. 2Pb + О 2 + 2Н 2 О = 2Pb (ОН) 2
Keď sa nalepíte na drsnú vodu, stočte sa do tenkej misky necitlivých solí a nerozpadajte sa.
Zriedený kyselinou chlorovodíkovou a kyselinou sirchanovou a nesmie reagovať s olovom. Koncentrovanou kyselinou kyselinou po zahriatí zadajte Pb (HSO 4) 2.
Zriedenou kyselinou dusičnou, činidlom, znížte koncentráciou. interakcia s lúkami Pb + 4КОН + Н 2 О = К 4 + Н 2 # hydroxoplumbite calia.
Oxidačné stupne sú charakteristické +2, +4
PbО = - zhovty prášok pri vyprážaní (500 ° C) napučal červeno -zhovtyovou farbou a nazýva sa litharge.
Hydroxid olovnatý Pb (OH) 2 amfotérny.
Pb (OH) 2 + 4 NaOH = 2 Na
Keď je Pb (OH) 2 legovaný zo suchých lúk, nachádzajú sa olovnaté soli:
Pb (OH) 2 + 2 NaOH = N a 2 PbО 2 + 2Н 2 О
Octan olovnatý je stabilizovaný na farbuvanny Pb (СН 3 СОО) 2
PbS - čierna farba. Daddy, zmocheniya razchin soli lead, shvidko dark, ako na svete є sirwater. Veľká reakcia na slanú vodu. Olovo Spoluki (IV) -Sil plumbati CaO + PbO = Ca PbO 3
Akumulátory sú uložené v malých kúskoch olovených dosiek, z ktorých jeden je naplnený oxidom olovnatým a іnshі - s kovovým hubovitým olovom. Platne sa nudia v rozsahu 35- 40% Н 2 SO 4. s ID robota, výboj: Pb + SO 4 2- ® PbSO 4 $ + 2е
Kovové olovo sa oxiduje a oxid olovnatý sa obnovuje.
PbО 2 + SO 4 2 - + 4Н + ® Pb SO 4 $ + Н 2 О
Elektróny, ktoré sú vedené atómami olova, sa prenášajú cez poslednú kopiju. Pb je anóda a PbO 2 je katóda. V prípade H 2 SO 4 je pozorovaný prenos iónov. Ioni SO 4 2- - zrútenie na anódu, H + - na katódu.








