Різні nekovy. Nekovy. Zagalny charakteristika. Atóm Budova. Fyzická sila
Prednáška 3. Nekovy
1. Zagalna charakteristika prvok-nekovový
Existuje iba 16 nekovových chemických prvkov a dva z nich, mušelín a kremík, ukladajú 76% hmotnosti pozemských osýpok. Nekovy sú skladované 98,5% hmotnosti roslínu a 97,6% hmotnosti ľudí. Všetky organické reči sú uložené v uhlí, vode, kyseline, sirkách, fosforu a dusíku, zápach je prvkami života. Voda a hélium sú hlavnými prvkami Vsesvity, sú z nich uložené všetky vesmírne objekty vrátane našej Sonce. Bez znalosti nekovov je nerozumné objavovať náš život, najmä ak sa predpokladá, že život je dôležitejší ako chemická spoluka - voda - je uložená s vodou a kyslosťou.
Nekovy - veľa chemických prvkov, atómov, ktoré spotrebúvajú elektroniku na dokončenie najenergetickejšej energie a sú vybavené mnohými negatívne nabitými.
Prakticky všetky nekovy môžu mať trochu malý polomer a skvelé číslo elektroniky na najdôležitejšej energetickej úrovni od 4 do 7, vyznačujú sa vysokou hodnotou elektronegativity a oxidačnej sily.
1.1. Poloha nekovových prvkov v periodických systémoch chemických prvkov Mendeleva
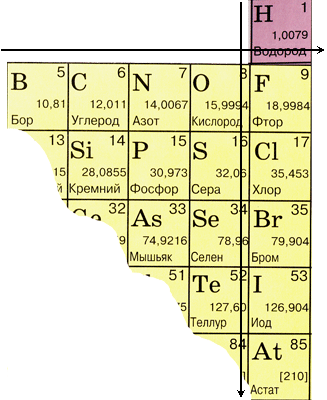
Ak v periodickom systéme vykonáte uhlopriečku od bóru k astatu, potom vpravo do kopca pozdĺž uhlopriečky budú prvky-nekovy a zlo nižšie-vrhne im prvky všetkých sekundárnych skupín potravín Uvidíme lantánové a aktinické skupiny. Elementy, roztashované blízko uhlopriečky, napríklad beryl, hliník, titán, germánium, surma, môžu mať dvojitý charakter a súvisia s kovom. Nekovové prvky: s-prvok-voda; skupina p -element 13 - bór; 14 skupín - v uhlíku a kremíku; 15 skupín - dusík, fosfor a mish'yak, 16 skupín - kissen, sіrka, selén a telur a všetky prvky 17 skupín - fluór, chlór, bróm, jód a astatín. Elementi 18 groups - inertný plyn, zaberajú špeciálny tábor, smrad po dokončení konečnej elektronickej gule a zaujímajú medzipolohu medzi kovmi a nekovmi. Х іnosyat na nekovy, aj keď formálne, na fyzické znaky.
1.2. Elektronická budova elementiv-nemetaliv
Prakticky všetky nekovové prvky na energeticky najefektívnejších môžu mať veľký počet elektrónov-od 4 do 7. Bórový prvok je analógom hliníka, vo všetkých troch elektrónoch je najpopulárnejším energeticky úsporným zdrojom energie, ale malý počet elektrických zariadení Obzvlášť významný je elektronický rozpočet. Ak je prvok prvkom, ale je ľahké prijať jeden elektrón, nastaviť hydridový ión a oxidáciu energie na kov.
Elektronická konfigurácia valenčných elektrónov nekovových prvkov v tabuľkách:
1.3. Zákony v zmene sily prvkov-nekovy
Existuje jasné chápanie zákonov v oblasti zmeny sily nekovových prvkov, ktoré by sa mali pripisovať jednému obdobiu a jednej skupine v súčasnej dobe Budova a ich atómov.
Obdobie:
Náboj jadra sa zvyšuje,
Polomer atómu sa mení,
Počet elektrónov pre najnovšie dodávky energie sa zvyšuje,
Elektronegativita sa zlepšuje,
Oxidácia moci akceptuje,
Nekovové úrady budú akceptovať.
Skupina má:
Náboj jadra sa zvyšuje,
Polomer atómu rastie,
Počet elektrónov na najnovšej energetickej úrovni sa nemení,
Elektronegativita sa mení,
Oxidácia sily oslabuje,
Nekovové sily sú slabé.
Takáto hodnosť, ktorá je správna a dôležitejšia, je prvkom v periodickom systéme, ktorý predstavuje silnejší obrat tejto nekovovej sily.
- náklady na polarizáciu drzých zvukov a získanie elektronických stávok pre seba.
Pre nekovy je akceptovaných 22 prvkov.
Poloha nekovových prvkov v periodické systémy chemické prvky
| Skupina | Ja | III | IV | V. | VI | VII | VIII |
| 1. tretina | H | On | |||||
| 2. tretina | V. | Z | N. | O | F | Ne | |
| 3. tretina | Si | P | S | CL | Ar | ||
| 4. tretina | Ako | Se | Br | Kr | |||
| 5. tretina | Te | Ja | Xe | ||||
| 6. tretina | O | Rn |
Atómový Budova nekovový
Charakteristickým znakom nekovov je väčší (v niektorých prípadoch kovov) počet elektrónov na nový zdroj energie. Cena je pred pridaním ďalšej elektroniky veľmi vysoká a bude vykazovať vyššiu oxidačnú aktivitu, v kovoch menej. Obzvlášť silná oxidačná sila, to znamená, že stav techniky je spojený s elektronikou, nachádzajú sa nekovy, ktoré sa nachádzajú v 2. a 3. perióde skupín VI-VII. Hneď ako zmeráme rozťažnosť elektrónov v orbitáloch v atómoch fluóru, chlóru a ďalších halogénov, môžeme posúdiť všetky dôkazy o sile. Atóm fluóru nemá žiadne silné orbitaly. Tento atóm fluóru môže byť zbavený valencie I a stupňov oxidácie - 1. Silné oxidačné є fluór... V atómoch iných halogénov, napríklad v atómoch chlóru, na rovnakej energetickej úrovni a vo forme d-orbitálu. Manažérov celej distribúcie elektroniky možno nájsť tromi rôznymi spôsobmi. V prvej kvapke môže chlór vykazovať oxidačné kroky +3 a meniť kyselinu chlorovodíkovú HClO 2, ktorá tvorí soli - chloritan, napríklad chloritan kalium KClO 2. V inom type môže byť chlór oxidovaný v stupni chlóru +5. K týmto sa zavádzajú soli kyseliny chlorečnatej a HClO 3 - chlorati, napríklad chlorečnan kalium KClO 3 (berthollet's sіl). Tretí typ chlóru vykazuje oxidačné kroky +7, napríklad v kyseline chloristej HClO 4 a v soliach - chloristan (v chloristane vápenatom KClO 4).Voľné molekuly nekovov. Fyzikálna sila nekovov
Plynový mlyn pri izbovej teplote má:· voda - H 2;
· dusík - N2;
· kissen - O 2;
· fluór - F 2;
· chlór - CI 2.
I vnútorný plyn:· hélium - He;
· neón - Ne;
· argón - Ar;
· kryptón - Kr;
· xenón - Xe;
· radón - Rn).
V. ridkom- bróm - Br.V. firma:
Telur - Te;
· jód - I;
· astatín - pri.
Nabagato bohatšie na nekovy a spektrum farieb: chervonia - vo fosforu, búrky - v brómu, zhovty - v sivej, zhovto -zelenej - v chlóre, fialovej - v stávke s jódom atď.Zistite, že niektoré nekovy môžu byť molekulárne a menej typov je nemolekulárnych. Dovoľte mi vysvetliť a vysvetliť pohľad úradov.
Sklad a sila jednoduchých slov - nekovy
Nekovy sa používajú ako monoatomické a diatomické molekuly. Predtým monatomický nekovy prijímajú vnútorné plyny, je praktické nereagovať na najaktívnejšie slová. Inertné plyny v skupine VIII periodických systémov a chemické vzorce bežných jednoduchých slov ofenzívy: He, Ne, Ar, Kr, Xe a Rn.
Deyakі nekovov dvojatómový molekuly. Ce H 2, F 2, Cl 2, Br 2, Cl 2 (prvky skupiny VII periodického systému), ako aj kyslík O 2 a dusík N 2. h trioatomické molekuly uchovávajú ozónový plyn (O 3). V prípade nekovových kapitol, ktoré sa nachádzajú v pevnom mlyne, je ľahké ich dokončiť pomocou chemického vzorca. Atómy v grafite v grafe sú jeden po druhom iným spôsobom. Je dôležité vidieť molekulu vo vodiacich štruktúrach. Pri písaní chemických vzorcov týchto rečí, ako napríklad vo forme kovov, sa zavádza v pare, takže tieto reči sa ukladajú iba z atómov. Chemické vzorce je možné písať aj bez indexov: C, Si, S atď. Také jednoduché slová, ako je ozón a ružová, sa môžu zdať byť rovnakým skladom (priestupok je uložený z jedného a toho istého prvku - kysnúť), ale pretože v molekulách je niekoľko atómov, v každom prípade sila. Kissen teda nezapácha, v tú hodinu je to ako ozón so štipľavým zápachom, ako keby to bolo na hodinu hrozbou. Sila pevných nekovov, grafitu a diamantu, môže mať rovnaký sklad, ale pomerne rýchlo sa rýchlo mení (grafit je ostrý, diamant je tvrdý). Takáto hodnosť, sila reči, nezačína iba akýmsi skladom, ale aj tým, že v molekulách reči sa odohrávajú atómy a ako je medzi sebou zápach viazaný. Nekovy sa nachádzajú v pevných alebo plynových staniach (vyklyuchauchi bróm-rіdina). Smrad nezapácha fyzickou silou, silou kovu. Pevné nekovy nie sú pre kov charakteristické, zápach má pískavú tendenciu, je zhnitý, aby viedol elektrický prúd a teplo (pre vinetu, grafit). Kryštalický bór B (rovnako ako kryštalický kremík) menej vysoká teplota tavenie (2075 ° С) a vysoká tuhosť. Elektrická vodivosť lesa v dôsledku teplotných úprav sa výrazne zvýši, takže existuje široká škála možností použitia v príslušnej technológii. Prísada bóru do ocele a zliatin hliníka, midi, niklu a niklu. Nakreslím mechanickú silu. Boridi (s polovicou bóru s pracovnými kovmi, napríklad s titánom: TiB, TiB 2) je potrebný na prípravu častí prúdových motorov, lopatiek plynových turbín. Jak je vidieť zo schémy 1, v uhlí - C, kremíku - Si, bóru - V máji idem do Budovy a volodyut s nejakým druhom zahraničných orgánov. Jednoducho povedané, zápach je vnímaný v dvoch druhoch - v kryštalickom a amorfnom. Kryštalické druhy prvkov cich sú ešte tvrdšie, s vysokými teplotami topenia. Kryštalický kremík nájdete v provinčných úradoch. Všetky prvky sú vyrobené z kovov - karbidu, silicidu a boridu (CaC 2, Al 4 C 3, Fe 3 C, Mg 2 Si, TiB, TiB 2). Deyaki z nich môže byť tvrdšie, napríklad Fe 3 C, TiB. Karbid vápenatý sa vikorizuje, aby sa odstránil acetylén.
Nekovy sú množstvo chemických prvkov, ktoré sa používajú jednoduchým spôsobom, ale nie vo fyzikálnej sile kovov. Zo 114 chemických prvkov je 92 upravených na kovy, 22 є nekovy. Nekovy - jednoduché slová, s duchaplnou mysľou to môžu byť plyny, hrebene a plné slová (obr. 46).
Malé. 46.
jednoduchá reč- nekovy
Laboratórny doslov č. 6
Nahliadnutie do zbierky nekovov
Pozrite sa na zbierku nekovov. Zapíšte si chemické vzorce nekovov, ktoré ste videli, a pretrepte ich v poradí rastu:
- schilnosti;
- tvrdosť;
- šľahačka;
- intenzita zimnej farby.
Pre vikonannya zavdannya vikorist doplnky 1 a 2, doplňujúce informácie dzherela.
Plyny є hélium He, neón Ne, argón Ar, kryptón Kr, xenón Xe, radón Rn. Їх sa nazývajú inertné plyny. Molekuly inertného plynu sú uložené v jednom atóme. Na najnovšej elektronickej guli v atómoch vnútorných plynov (pomocou hélia) sú elektronické zariadenia. Hélium má dve. Vďaka svojmu chemickému štýlu sú falošné kovy falošné - zlato a platina a majú aj iný názov - vzácny plyn. Je lepšie ísť do vnútorných plynov, ktoré napriek tomu vstupujú do jedného chemické reakcie a založiť s polovicou. V roku 1962 boli oznámené tie, ktoré sú očistené od xenónu fluórom. Infekcia viac ako 150 -krát xenónom, kryptónom, radónom fluórom, kyselinou, chlórom a dusíkom.
Nebudeme schopní získať uznanie o chémii ročníkov vzácnych plynov, a preto budeme nahradení prenosom nulovej skupiny z vnútorného plynu a násilníka do skupiny VIII (skupina VIIIA) tabuľky DI Mendeleva.
Gelієm, kvôli jednoduchosti robenia iba vody, ale z pohľadu zvyšku nehorľavých, to znamená, nepredstavujte si žiadnu zbytočnosť, vypnite vzducholode a vzducholode (obr. 47).

Malé. 47.
Zapnite vzducholode a zapnite vzducholode
Neon vikoristovuyut na vytváranie svetelných reklám (obr. 48). Uhádnete obrazné zavesenie „v uliciach bulvy zaplavenej neónom“.

Plyn a voda, kissen, dusík, chlór, fluór tvoria dvojatómové molekuly, ako H 2, O 2, N 2, Cl 2, F 2.
Sklad reči je zobrazený na listoch, vikoristových a chemických znakoch a číslach - indexoch, pre ďalšie chemické vzorce. Ako už viete, pre chemický vzorec vypočítajte prípustnú molekulovú hmotnosť reči (Mr). Bežná molekulová hmotnosť jednoduchej reči sa navyše pridá k hmotnosti jednoduchej atómovej hmotnosti počtom atómov v molekule, napríklad O 2:
Мr (02) = Аr (0) × 2 = 16 × 2 = 32.
Prvok kissen však potvrdzuje ešte jednu plynovú reč - ozón, až do zásoby molekúl, ktoré obsahujú tri atómy kyseliny. Chemický vzorec pre ozón je 0 3 a jeho obvyklá molekulová hmotnosť: Мr (03) = 16 × 3 = 48.
Sila alotropických modifikácií chemického prvku kyslé - jednoduché slová kyslé O 2 a ozón O 3 - rosa. Kisen nemá žiadny zápach, ale ozón vonia (zvuk a jeho názov - vo vlašskom orechu ozón znamená „vôňa“). Celá vôňa, vôňa sviežosti, môžete ju hodinu vidieť ako hrozivú, pretože ozón je v niektorých prípadoch v dôsledku elektrických rozvodov nastavený v malých množstvách.
Kisen je plyn bez farby a ozón má nízku farbu. Ozón je baktericídnejší (lat. Tsidao - vbivati), nіzh kisen. Na tento účel sa ozón používa na úpravu pitnej vody. Ozón v ultrafialovom spektre spánkového spektra, zuby pre všetko živé na Zemi a ozónová guľa, ktorá môže rásť v atmosfére vo výške 20-35 km, vezme život na našej planéte Spoločník Zeme, de oblasť redukovaného ozónu v atmosfére („ozone diri“) je označená veľkou farbou).
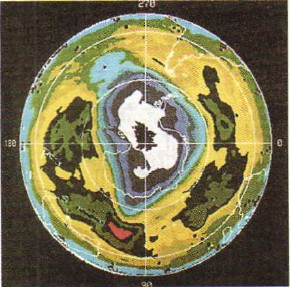
Malé. 49.
"Ozonovi diri" v atmosfére Zeme
Tri jednoduché slová - nekovy s extravagantnou mysľou, iba bróm, molekuly rozsievok. Vzorec pre bróm je Br 2. Borax je veľmi dôležitý, s neprijateľným zápachom ridinu (je to názov, pretože bróm je dlhodobý grécky názov „smradľavý“).
Deyakі pevné reči - nekovy z nájdených hodín - cena sirky a uhlia (vo forme dreveného dreva, diamantu a grafitu).
Tvrdými slovami - nekovy, je tiež možné zabrániť prejavu alotropie. Prvok v uhlí je teda pre výzvu jednoduchej reči nastavený na rovnakú veľkosť, ako diamant, grafit (obr. 50). Dôvod, prečo vynikne sila diamantu a grafitu poľa v budovských krištáľových mriežkach cichského bohatstva, ako vidíte obtlačkovú pizzu.
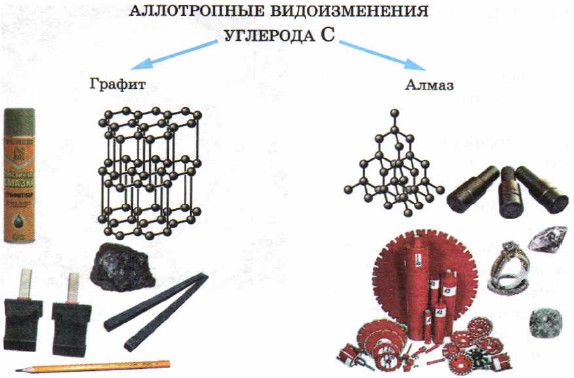
Malé. 50.
Alotropické druhy v uhlí a regiónoch a regiónoch
Prvok fosfor je dve alotropické modifikácie: fosfor chervonia (pokrýva druhú stranu sirnikovho poľa) a fosfor bilium. Zostávajúca machotiriatomická molekula, ktorej sklad je vzatý do úvahy vzorcom P 4.
Pevná reč - nekovový є kryštalický jód s dvojatómovou molekulou I 2. Nezablúdite alkoholovým roztokom na jód - jódovú tinktúru, ako є v kožnej domácej lekárni.
Kryštalický jód a grafit nie sú podobné tým jednoduchým slovám - nekovy, vonia ako kovová šľahačka.
Aby sa ukázala platnosť základu jednoduchých fráz na základe fyzikálnych autorít na kovových a nekovových, je alotropia chemického prvku cín Sn rozpoznateľná. Pri izbovej teplote zmrazte beta-cín (β-Sn). Vždy, bez ohľadu na to, koľko je cínu, kovu, z ktorého predtým videli cínových vojakov (obr. 51, a) (hádajte Kazku z Kh. K. Andersena “ cínový vojak"). Stred plechoviek prikryte cínom (obr. 51, b). Vono vstúpte do skladu takého druhu zliatiny, jakového bronzu a tiež spájky (obr. 51, c).

Malé. 51.
Oblasti zberu cínu:
a - grashki; b - výroba plechoviek; c - pripіy
Pri teplotách nižších ako +13,2 ° С je stykisha alfa-cín (α-Sn) sivý jemný kryštalický prášok, ktorý je oveľa rýchlejší ako sila nekovu. Proces transformácie bieleho cínu v strede sveta na všetko pri teplotách až -33 ° C. Proces transformácie budem obrazne nazývať „cínový mor“.
Zhruba teraz existujú jednoduché slová - kovové a nekovové podľa dodatkovej tabuľky 3.
Tabuľka 3
jednoduchá reč

Kľúčové slová a slová
- Vznešený Gazi.
- Alotropia a alotropické druhy alebo modifikácie.
- Kisen a ozone.
- Diamant a grafit.
- Fosfor, chervónia a bilium.
- Cín žlče a otca.
- Životaschopnosť bežných slov na kovových a nekovových.
Robot s počítačom
- Staňte sa elektronickým doplnkom. Vivchit materiál lekcie a vikonayte preponated zavdannya.
- Zoznámte sa s elektronickými adresami na internete, ktoré môžu slúžiť ako dodatočné písmena, aby ste mohli otvoriť zmenu kľúčových slov a slova v odseku. Propagujte svoju pomoc čitateľovi pri príprave novej hodiny - prečítajte si o tom viac v kľúčových slovách a slová prijaté z urážlivého odseku.
Napájanie a napájanie
- Pozrite sa na etymológiu názvu vzácnych plynov okremikh.
- Prečo je zvrat „Vonia to ako búrka“ šik a nepoleticky poeticky?
- Napíšte diagramy schválenia molekúl: Na 2, Br 2, O 2, N 2. Aký typ chemickej zlúčeniny sa nachádza v molekulách?
- Aký typ chemického zvuku môže za kovovú vodu?
- Expedícia polárneho vetroňa R. Scotta na pólový pól v roku 1912 presadila tých, ktorí spotrebovali celú zásobu ohňa: našli ho v zapečatených cínových nádržiach. Aký typ drzého procesu je jeho jadrom?
>> Khimiya: Jednoduché slová nie sú kovy
Nekovy - veľa chemických prvkov, ktoré je možné použiť jednoduchým spôsobom reči, ale nie vo fyzikálnej sile kovov. Zo 109 chemických prvkov je 87 kovov, 22 є nekovov.
6. Životaschopnosť bežných slov o kovových a nekovových.
Pozrite sa na etymológiu názvu okremikh vzácnych kovov.
Čím to je, že to voňalo ako búrka šik, nepoleticky poeticky?
Napíšte schémy schvaľovania molekúl: Na2, Br2, O2, N2. Aký je typ väzby v molekulách qix?
hodina, lekcia osnova lekcie podporný rámec prezentácie k lekcii akceleračnej metódy interaktívnych technológií Prax manažment a právo na vlastnú revíziu prostredníctvom workshopov, školení, kazuistiky, diskusie o domácom štúdiu výživa rétorická výživa od akademických pracovníkov іlustratsії audio, video a multimédiá fotografie, obrázky, grafika, tabuľky, humoristické schémy, anekdoty, vtipy, komiksové podobenstvá, príkazy, krížovky, citáty doplnky abstraktnéštatistiky doplnkov podvádzanie listov ručne písaný základný a doplnkový slovník Dobrá kvalita pre deti a hodinypresmerovanie milostí na príjemcu Aktualizácia fragmentu v príručke Prvky inovácie na úrovni nahradenia starých znalostí novými Tilki pre čitateľov ideálne hodiny kalendárny plán pre pik metodické odporúčania vyjednávanie programu integrované hodiny






