Флуорът зависи от силата на окислителя. окислителна мощност
СТОЙНОСТ
флуор- елемент, който може да се приложи към група халогени. Въртене в друг период на VII група подгрупа А. Обозначение - F.
Флуорът е неметал. Найбилш електроотрицателен елемент. В нечестивите умове флуорът е газът на цъфтящата колора. Otruyniy.
В малки концентрации миризмата на флуор е нагад миризмата на озон и хлор е един час.
Молекула флуор двуатомна F 2. Володя има най -ниската поляризуемост от средните халогени. Точката на топене на флуора е необичайно ниска. Не е отворен за вода, така че може да се съхранява (2F 2 + 2H 2 O = 4HF + O 2).
Етап на окисляване на флуор
Флуорът превръща двуатомните молекули в склада F 2 за индуциране на ковалентни неполярни връзки и, както изглежда, в помещенията с неполярни връзки на стъпалата на окислените елементи по пътя нула.
характеризира се с флуор най -големите ценностиелектроотрицателност, в неговите данни винаги има постоянно отрицателен етап на окислен път (-1) (HF -1, OF -1 2, NaF -1 и т.н.).
Настройте задачи
ПРИЛОЖЕНИЕ 1
| завданя | В нитрида азотът показва етапи на окисляване -3. За съхраняване на формулите за нитриден литий, нитридна лента и нитриден силиций. |
| Решение | Изглежда, че литийът на етапите на окисляване (+1). За да съберете формулата, запишете стойността химични елементиа също и етапите на окисляване: По аналогичен ранг на склада те формулират нитридна лента и нитриден силиций. Вонята ще бъде майката на офанзивната виглиада: Ba 2 N 3 и Si 3 N 4. |
| vidpovid | Li 3 N, Ba 2 N 3 и Si 3 N 4. |
ПРИЛОЖЕНИЕ 2
| завданя | Въглеродните въглехидрати показват етапи на окисляване -4. Съхранявайте формулите за калциеви и алуминиеви карбиди. |
| Решение | Изглежда, че калцият и алуминият са окислени стадии (+2) и (+3), очевидно. Броят на етапите на окисляване е типичен за тези химични елементи. За да се използва формулата, съответните химични елементи, както и етапите на окисляване могат да бъдат записани: Знаем най-малкото пространство (знакът "-" или "+" не е враховуемо): Rozdílimo се изважда от стойността на етапа на окисляване и числата се записват в индексите, така че редица атоми от кожния елемент се добавят към склада на молекулите: |
| vidpovid | CaC 2 и Al 4 C 3. |
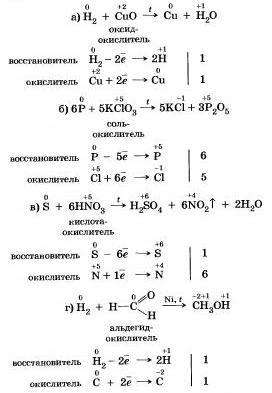
Окислително-водещи реакции (OVR)- редица химични реакции, при които прехвърлянето на електрони от някои частици (атоми, молекули, йони) към други, в резултат на което се променят стъпките на окислени атоми, които влизат в склада на частиците от частици .
Наличието на атоми, при които стъпките на окисляване се променят в хода на реакцията, е характерен признак на OVR.
perebig химична реакциякато цяло той се излива чрез размяна на части и реагиране с думи. Често обменът на надзорници се осъществява чрез преход на електрони от едно парче в друго. И така, с цинкови витамини в среда, под формата на среден (II) сулфат
Zn (t) + CuSO 4 (p) = ZnSO 4 (p) + Cu (t)
електроните от цинкови атоми преминават към йони:
Zn (t) = Zn 2+ (p) + 2 д,
Cu 2+ (p) + 2 д= Cu (t),
Або накратко: Zn (t) + Cu 2+ (p) = Zn 2+ (p) + Cu (t).
Процесът на използване на електрониката често се нарича окисленаи процеса на използване на електронни устройства - актуализации... Окисляването и обновяването се извършват наведнъж, така че във връзка с прехода на електрони от някои частици към тези, които те наричат окислително-водещи реакции.
Ще опиша окислително важните реакции с цел видимост. етап на окисляване (n)- формален заряд, който може да бъде приписан на атом, който може да влезе преди склада на която и да е част (молекула, йон), когато става въпрос за чисто йонната природа на връзката в дадената частица (частта е съставена от йонизирана атоми). Като плъзгач на паметта стойността на n не се върти в висулки, а в броя на наличните (приети) електронни устройства. Зарядът на едно електронно устройство е -1.60218 · 10 -19 Cl.
Твърде много окислително-редукционни реакции контролират промяната на етапите на окисляване на елементите, за да участват в реакцията на речта . Когато се подновяват стъпките на окислен елемент, се променят, когато се окисляват - се променят . Речовина, преди склада, който включва елемент, който понижава стъпките на окисляване, викам окислява, Речовина, преди склада, който включва елемент, който движи стъпките на окисляване, викам виновникът.
Етап на окисляванеЕлементът в дадената форма започва съгласно следните правила:
1. етапът на окисления елемент в обикновена реч е нула;
2. алгебрична сума от всички етапи на окисляване на атомите в молекулите до нула;
3. алгебричната сума на всички етапи на окислени атоми в сгъваем йон, както и стъпките на окислен елемент в прост моноатомен йон, предварително зареждане на йон;
4. отрицателните стъпки на окисляване се появяват на фона на атома на елемента, който е по -малко електрически отрицателен;
5. максималната възможна (положителна) стъпка на окисляване на елемента съответства на номера на групата, при която елементът се отстранява в Периодичната таблица на D.I. Менделева.
6. При тези с йонен и ковалентно-полярен характер, връзката е по-електрически отрицателни атоми под формата на по-ниски нива на окисление
7. В двоичните файлове неметалните атоми като правило са най-малките етапи на окисляване
8. Локви от метал (+1), метал група ръководители II група (+2)
9. Когато нивото на окисляване е маркирано, промяната се показва като елемент, който се показва в таблицата. Например, в CaO 2: n (Ca) = +2, n (O) = - 1
10. етапи на окислена киселинност по пътищата -2, за винетка от пероксид (-1) и кисел флуорид OF 2 (+2).
11. водата показва етапи на окисляване +1 във всички системи, с изключение на хидридите на метали (NaH, CaH) 2 и т.н.), стъпки на окислени пътища -1;
Редица елементи на фона се появяват в края на етапите на окисляване, но е порочно, когато са посочени етапите на окисляване:
1) флуор, който може да се намери в средата на електроотрицателните елементи, при всички нива на окисление -1;
2) вода в кладенците на етапите на окисляване +1, с изключение на хидридите на металите (-1);
3) хвърли IA p_dgruppi през цялото време на окисляване +1; 4) метална IIA група, както и цинк и кадмий във всички случаи могат да имат етапи на окисление +2;
4) стъпки на окисляване с алуминий в диапазона +3;
5) стъпките на окисляване на киселинността в половините пътища -2, зад винетка, при някакъв вид окисляване в присъствието на молекулярни йони: О 2 +, О 2 -, О 2 2 -, О 3 -, както и като флуориди О х F 2.
Етапите на окисляване на атомите на елементите на даденото място трябва да бъдат изписани върху символа на този елемент, включително знака на етапа на окисляване, а след това и броя на стойностите, например 4, въз основа на заряда на йон, който трябва да запише знака вдясно, а след това 2+, SO 4 2-.
Окислително -значителната сила на атомите на други елементи се проявява в наличието на различни фактори, най -важните от които - електронният елемент на Буда, стъпките на окисляване в речта, естеството на силите на останалите участници в реакцията . Z'udnannya, преди склада на който да се въведат атомите на елементите в максималния му (положителен) етап на окисляване, например KO 4, K 2 2 O 7, HO 3, O 2, може да се види само в окисляването. В полюсите може да има някои елементи в най -ниското ниво на окисление, например H 3, H 2, H, могат само да се окисляват и да се появят в качеството на прототипите. Записи, които да отмъстят на елементите в междинните етапи на окисляване, например H O 2, H 2 ,,, Cl 3, O 2, могат да окислително-специфично подразделение... Независимо от партньор в реакцията на такива думи за изграждането и приемането, и за доставката на електроника. Склад за обновяване и окислени продукти също може да се съхранява като различни фактори, включително средния етап, в такава химична реакция, концентрацията на реагентите, активността на партньора в процеса на окисляване. Необходимо е благородниците да променят степента на окисляване на елементите и в двата случая, за да се промени степента на окисляване, е необходимо за благородството.
Найважив_ш_ окисляващ. Въведените халогени надуват стъпките на окисляване -1, при което формата на флуор до йод, окислителната сила е слаба (F 2 може да бъде заобиколен от наличието на висока агресивност):
2H 2 O + 2F 2 = O 2 + 4HF
мусен O 2, в допълнение, етапи на набъбване на окисляване -2:
4Fe (OH) 2 + O 2 + 2H 2 O = 4 Fe (OH) 3
Азотна киселина HNO 3 проявява окислителна сила за освобождаване на азот в окислителната фаза +5:
3Cu + 8HNO 3 (разреден) = 3Cu (NO 3) 2 + 2NO + 4H 2 O
Когато има широка гама от одобрени нови продукти:
NO 3 - + 2H + + д= NO 2 + H 2 O
NO 3 - + 4H + + 3 д= NO + 2H20
NO 3 - + 5H + + 4 д= 0,5 N 2 O + 2,5 H 2 O
NO 3 - + 6H + + 5 д= 0.5N2 + 3H20
NO 3 - + 10H + +8 д= NH4 + + 3H20
Азотният глибин се отлага като концентрация на киселина, както и активността на оловото:
концентрация на киселина
¾¾¾¾¾¾¾¾¾¾¾¾¾
NO 2 NO N 2 O N 2 NH 4 +
¾¾¾¾¾¾¾¾¾¾¾¾¾®
дейност на водещия следовател
Солна азотна киселина ( нитрати) Може да се използва в кисели метали и заедно с активни метали, в локвички, както и в стопилки:
Zn + KNO 3 + 2KOH K 2 ZnO 2 + KNO 2 + H 2 O
Царска горилка- сумата от концентрирана азотна и солна киселина, намаляването на съотношението 1: 3 по обем. Името на тази сумиши е свързано с тима, така че няма да намерите такива благородни метали като злато и платина:
Au + HNO 3 (conc) + 4HCl (conc) = H + NO + 2H2O
Сирчана киселина H 2 SO 4 окислена мощност в концентриран диапазон за зърно вода в етап на окисляване +6:
C (графит) + 2H 2 SO 4 (конц.) CO2 + 2SO 2 + 2H 2 O.
Складът на продукти за подновяване е основната дейност по обновяване и концентрация на киселина:
SO 4 2- + 4H + + 2 д= SO2 + 2H2O
SO 4 2- + 8H + + 4 д= S + 4H20
SO 4 2- + 10H + + 8 д= H 2 S + 4H 2 O
концентрация на киселина
¾¾¾¾¾¾¾¾¾¾¾¾¾
¾¾¾¾¾¾¾¾¾¾¾¾¾
дейност на водещия следовател
Тези соли често са порочни като окисляващи, ако имат двоен характер. По правило продуктите от обновяването на цих сполук са хлориди и бромиди, както и йод:
MnS + 4HClO = MnSO 4 + 4HCl;
5Na 2 SO 3 + 2HIO 3 = 5Na 2 SO 4 + I 2 + H 2 O
калиев перманганат KMnO 4 се окислява за манган в степента на окисление +7. Погрешно от средата, по обратния начин на реакция, той се въвежда в младите продукти: в киселата среда - в манганови (II) соли, в неутрален - в манганов (IV) оксид в манганатна форма MnO ( - OH) 2, в буйния йон MnO 4 2-:
кисела среда:
5Na 2 SO 3 + 2KMnO 4 + 3H 2 SO 4 (разреден) = 5 Na 2 SO 4 + 2MnSO 4 + 3H 2 O + K 2 SO 4
неутрална средна:
3Na 2 SO 3 + 2KMnO 4 + 3H 2 O = 3Na 2 SO 4 + 2MnO (OH) 2 ¯ + 2KOH
локва средно ниво:
Na 2 SO 3 + 2KMnO 4 + 2KOH = Na 2 SO 4 + 2K 2 MnO 4 + H 2 O
калиев дихромат K 2 Cr 2 O 7, преди съхранението на молекулата, хромът влиза в стадия на окисление +6, е силно окисляващ се в случай на подкисляване:
6KI + K 2 Cr 2 O 7 + 7H 2 SO 4 (s) = 3I 2 + Cr 2 (SO 4) 3 + 7H 2 O + 4K 2 SO 4
в неутралната среда:
3H 2 S + K 2 Cr 2 O 7 + H 2 O = 3S¯ + 2Cr (OH) 3 ¯ + 2KOH.
Сред силата на окисляване окисляването е придружено от присъствието на Н + и метала в окислената област. йон vodnyu H + вистува като окисляване по време на взаимодействието на активни метали с разреждане на киселини (с вината HNO 3): Mg + H 2 SO 4 (разреждане) = MgSO 4 + H 2
Ioni металпри относително високо ниво на окисляване, като Fe 3+, Cu 2+, Hg 2+, които се въвеждат, се трансформират в по -високо ниско ниво на окисление:
H 2 S + 2FeCl 3 = S¯ + 2FeCl 2 + 2HCl
Защото от разликите в солите в металите се вижда:
2Al + 3CuCl 2 = 2AlCl 3 + 3Cu.
Newswires.Преди типичните за средата прост разговорактивни метали като локвени и локвени земни метали, цинк, алуминий, злато и др., както и неметали (вода, въглерод, фосфор, силиций): Zn + 2HCl = ZnCl 2 + H 2
C + 4HNO3 (конц., Gir) = CO 2 + 4NO 2 + 2H 2 O
Основните функции на водата са безкиселинни, като Cl -, Br -, I -, S 2 -, H -и метални катиони в долния етап на окисляване:
2HBr (conc) + H2O2 (conc) = Br 2 + 2H2O;
2CaH 2 + TiO 2 2CaO + Ti + 2H 2.
2FeSO 4 + H 2 O 2 (конц.) + H 2 SO 4 (разреден) Fe 2 (SO 4) 3 + 2H 2 O.
Окислително известен двоен. Сред прости думи, окислително известният двойник е характерен за елементите VIIA, VIA и VA група, които могат както да увеличат, така и да намалят етапите си на окисляване.
Често побеждава като окисляване, халогенот друга страна, за по -силни окислители те изглеждат по -мощни (с вина за флуор). Окисленият капацитет на сградата ще се промени и обемът на сградната мощност ще се увеличи от Cl 2 до I 2. Особеността на светлинната реакция на йод, окислен от хлор във воден разтвор: I 2 + 5Cl 2 + 6H 2 O = 2HIO 3 + 10HCl .
Киселини и халогении техните солПреди складирането на молекули, които включват халоген в индустриалния етап на окисляване, може да има нещо повече от окисляване:
S + NaClO 2 NaCl + SO 2
ale и vídnovnikіv:
5NaClO 2 + 2KMnO 4 + 3H 2 SO 4 (разреден) = 5NaClO 3 + 2MnSO 4 + 3H 2 O + K 2 SO 4
кислородна водаЗа да отмъсти на кисен в окислителния етап -1, в присъствието на типични редуктори, има окислителна сила, така че кисен може да намали своите окислителни стъпки до -2:
2KI + H 2 O 2 = I 2 + 2KOH
и в случай на взаимодействие със силни окислители, силата на главния герой се проявява (стъпки на растеж на окислена киселина до 0):
H 2 O 2 + 2Hg (NO 3) 2 = O 2 + Hg 2 (NO 3) 2 + 2HNO 3.
азотна киселинаі нитрити, Преди склада, който включва азот в етапите на окисляване +3, той може да се използва и като окислител: 2HI + 2HNO 2 = I 2 + 2NO + 2H 2 O,
така и в ролята на референтната: 2NaNO 2 (dil, gir) + O 2 = 2NaNO 3.
Инфузията на киселинност на средния етап при изгледа на продуктите в реакцията е особено добре осъществена в областта на обновяването на перманганатния йон MnO 4 -.
а) в кисела среда, Според първата схема, срещу възможно най -доброто обновяване на мангановия атом.
MnO 4 - + 8H + + 5e - → Mn 2+ +4 H 2 O.
В същото време се установяват манганови (II) соли, чийто анион се намира под формата на киселина, но също така и киселинната среда. И така, в киселата среда се образува MnSO 4, в солевия слой MnCl 2. Значително, че металният манган не може да бъде приет, тъй като металът в реда, другите метали по -често са по -воднисти и окисляват ionamіH +. б) в неутрално(Слабо студен или слабо кисел среден) перманганат-йон се въвежда в манганов диоксид MnO 2 , Scho vipadaê z линията при черно-кафявата обсада на виляди
MnO 4 - + 2Н 2 О + 3е - → MnO 2 + 4ОН -.
Като цяло, често има заключване на розата.
v) в много кална средаПрехвърлянето на електрони ще дойде с големи трудности (чрез голяма концентрация на отрицателно заредени йони ON -). Ремонт на манганатен йон MnO 4 2-, който е по-зелен:
MnO 4 - + 1е - → MnO 4 2-
Пеещо уважение към необходимостта да се покаже кога роботи с хром (VI). Вдясно, в това, много силно в киселата среда Дихромат-йон Cr 2 O 7 2-, има силна окислителна сила, в средата на локвата, без промяна на степента на окисляване, Той се трансформира в хромат-йонCrO 4 2-, което е още по-слабо окислително.
Cr 2 O 7 2- + 2OH - → 2CrO 4 2 + H 2 O
Navpaki, хромат в кисела среда, дихромат.
2CrO 4 2 + 2Н + → Cr 2 O 7 2- + Н 2 О
В кисела среда йонът Cr 2 O 7 2- се повишава до йони Cr 3+:
Cr 2 O 7 2- + 14H + + 6e - → 2Cr 3+ +7 H2O
В зависимост от конкретния прототип и реалните киселинно-алкални параметри, диапазонът на хрома може да се наблюдава или преди обсадата на Cr (OH) 3, или, в резултат на амфотерните сили на хром (III), до критичния комплекс анион 3. Във всички продукти ще бъде налична актуализация на хрома + III.
От друга страна, ако се окислява с хром в центъра на локвата, тогава окислените продукти ще бъдат хромат CrO 4 2-, ако окислените се добавят към кисела среда, тогава окислените продукти ще бъдат Cr 2 O 7 2 -.
Инжектиране на концентрация в склада на реакционните продукти
Инжектирането на концентрацията на реактивни течности в OVR най -вероятно ще се прояви в прилагането на реакции с азотна и солна киселина.
Реакции на азотна киселина.
Nagadaêmo, tsі киселина и един час и и окисляване, и създатели на средата.
Азотната киселина реагира, като окисляваща, с метали, оксиди и метални хидроксиди в междинните етапи на окисляване, с неметали и техните оксиди, така че неметалът се заменя в междинния етап на окисляване. По правило продуктите от обновяването на азотната киселина образуват сума от реховини (като правило, оксиди), макар че при наличие на концентрация същият продукт ще бъде смесен в реакционна сума. Чрез експериментален път булото установи началото на законите:
Към него се добавя концентрирана азотна киселина НЕ 2 .
NO 3 - + 2H + + 1e - → NO 2 + H 2 O
Азотната киселина се разрежда по реда на величината. НЕ.
NO 3 - + 4H + + 3e - → NO + 2H 2 O
Азотната киселина се разрежда допълнително, реагирайки с активен предшественик (Mg, Ca, Ali и др.) Се добавя към амониева сол - нитрат NH 4 НЕ 3 .
NO 3 - + 10H + + 8e - → NH 4 + + 3H 2 O
Складът на възобновяеми продукти може също да включва газообразен азот N 2, N 2 O.
1. В атмосфера на флуор такива стийки думи изгарят,
Як скло (при вигляди вати), вода. Един от продуктите на мината е kissen, т.е. флуоровият яко се окислява по -кисело:
SiO2 + 2F2 → SiF4 + O2;
2H2O + 2F2 → 4HF + O2.
2. Активно обменяйте флуор с по -прости думи. Със сирои и фосфор спечелете модалност при температура на рядък здрач (-190 ° C):
S + 3F2 → SF6;
2P + 5F2 → 2PF5.
Флуорът се окислява до navit deyaki вътрешни газове (ксенон),
ейл не във връзка с гел, неон и аргон:
Xe + 2F2 → XeF4.
Най -активният неметал, шумно преплетен с използването на римата, светлината, флуоридите в по -високите етапи на окисляване и червеникавите виняти - флуоропласти, а от повече от тях - от мините. До флуор при стайна температура бяха предприети стъпките за получаване на флуорид, галмовата реакция с флуор - Al, Mg, Cu, Ni.
Приведете флуора в контакт с водата, докато се абсорбира и го навийте с лък ниски температури(До -252 ° C ). В атмосфера на флуор за изгаряне на вода и платина:
2F2 + 2H2O → 4HF + O2
Преди реакции, при които флуорът официално е главният герой, реакциите на разпределение на други флуориди, например:
2CoF3 → 2CoF2 + F2
MnF4 → MnF3 + 1/2 F2
Флуорът може да се окисли и в електрически контакт, а флуоридът също е окислен OF2 и диоксидифлуорид O2F2.
Във всички случаи флуорът показва етапи на окисление -1
На химиците в далечината, отнемете дифлуоридния киселин, за да могат да се преструват с флуор на слаба поляна:
2F2 + 2NаОН = 2NаF + OF2 + H2O.
Азотният флуор не може да бъде изоставен, но през 1928 г. азотният трифлуорид NF3 е отстранен по непряк път от флуора на Ото Руфо. Видоми и инши флуор, смесен с азот. Когато получите достъп до него, той ще започне да свети. Село Вугила спалахху в атмосфера на флуор при високи температури.
Златото в студа се смесва с флуора още повече и когато се пържи, изгаря в ново. Платината, с изключителни умове, не реагира с флуор, ейлът изгаря в нов при нагряване до 500-600 ° C.
С бор, силиций, фосфор, мишяк Флуорът се използва в студени условия, както и образува флуорид.
Когато флуорът взаимодейства с метални оксиди в студа, флуоридните метали и кисен се втвърдяват; Възможно е също така да се одобри метален оксифлуорид (например MoO2F2). Оксиди на неметали или за допускане на флуор, например SO2 + F2 = SO2F2, или кислородът в тях се заменя с флуор, например SiO2 + 2F2 = SiF4 + O2. Sklo реагира по -често с флуор ;. Оксидът и азотът NO и NO2 са лесни за приемане на флуор от състава на нитрозил флуорид FNO и нитритен флуорид FNO2. Оксид във въглерод (II), въведен във флуор при нагряване с разтвори на карбонилфлуорид: CO + F2 = COF2.
Метален хидроксид реагира с флуор, превръщайки метален флуорид и калай, например 2Ва (ОН) 2 + 2F2 = 2BaF2 + 2Н2О + О2. водни разтвори NaOH и KOH реагират с флуор при 0 ° С според OF2.
Метални халогениди или неметали се обменят с флуор на студено и флуорът замества всички халогени.
Лесно флуориращ сулфид, нитрид и карбид. Металните хидриди се създават с флуор в студа, метален флуорид и HF; амиак (по двойки) - N2 и HF. Флуорът е заместен с вода в киселини или метали в техните соли, например HNO3 (или NaNO3) + F2 = FNO3 + HF (или NaF); в по -твърдите умове Флуорът е vitisnyaê kissen от цих сполук, който може да се използва като сярен флуорид, например Na2SO4 + 2F2 = 2NaF + SO2F2 + O2. Карбонатите и неземните метали реагират с флуор при екстремни температури; в същото време има смес от флуорид, CO2 и О2.
Флуорът енергично реагира с органична реч.
промийте флуорана вилни стани електролиз
разтопени съединения (HF в разтопен дихидрофлуорид на калций KH2F3).
Dzherel за virobniztva Флуорът е флуоридна вода, която преминава основно или с наличието на солна киселина H2SO4 · за флуорит CaF2, или с преработката на апатит и фосфорит .. за разпределение на други флуориди
2CeF4 = 2CeF3 + F2
Концентрирайте се с вода, флуорът ще бъде газообразен за един ден - водороден флуорид HF... Водородните флуоридни водни разтвори се наричат флуороводородна киселина. Газоподобният HF е газ без брада с остър мирис, дори по-драматично върху дисфункционалните организми и лигавиците.
отхвърлянеМного специален начин да го отхвърлите е използването на солна киселина за флуороспар CaF2:
CaF2 + H2SO4 = CaSO4 + 2HF.
Флуор с вибух взаимодействие с вода при ниски температури и (по отношение на хлор) при температура с разтвори на флуороводород:
H2 + F2 → 2HF.
Молекулата на флуороводорода е силно полярна, μ = 0,64 · 10-29 Cl Енергията на водните съединения FH FH става приблизително 42 kJ / mol, а средните етапи на полимеризация в газовата фаза (при температура на кипене) ≈4. Navit в газоподобна мелница, флуороводородът се съхранява от сумата от полимери H2F2, H3F3, H4F4, H5F5, H6F6. HF молекулите са лесни за оцеляване при температури до 90 ° C. В същото време, висок температурен спад във флуороводорода ще намали температурата от 3500 ° C (по -скоро като температурата на топене на волфрам - най -огнеупорен метал ). За овесена каша - във вода, температурният спад ще стане по -ярък при температури до 2000 ° C.
В HF кристалната мелница се образуват орторомбични кристали, които се сгъват във вериговидни структури: нарязани HFH = 116 °, d (F-H) = 95 pm, d (F H) = 155 pm. аналог zy´za´opodibnі
lantsyuga с отрязан HFH = 140 °) може да бъде в полимерна HF, в газова фаза.
Флуороводородна киселина. Веселите власти дие на всички хвърлени, зад винетка от злато и платина. Средно и средно флуороводородната киселина е още по -често срещана. Слабият разчини я абсолютно не важи за калай, мед и бронз.
Устойчив на флуороводородна киселина и олово, който може да бъде покрит с топка от оловен флуорид, която може да се използва за защита на метала от дадена разруха. За това олово и служи като материал за апаратите за производство на флуороводородна киселина.
Охлаждането на молекулите на НФ трябва да се осъществи преди средните соли на флуороводородна киселина и киселина, например KHF2 (с която флуорът се отстранява чрез електролиза). В същото време разликата в броя на водоводородните киселини, която дава само средните соли.
Характерната особеност на флуороводородната киселина, която е получена от всички други киселини, е изключително лесна за силициев диоксид SiO2 и соли на силициева киселина:
SiO2 + 4НF = SiF4 + 2H2O.
Силициев тетрафлуорид SiF4 - газ, изпарен по време на реакцията.
Dіyuchi върху силициев диоксид, scho да влезе в склада на склона, флуороводородна киселина роза sklo, следователно, не е възможно да се получи в sklyany съдове.
От органични течности флуороводородната киселина се използва за папир, дърво, корк, въглена киселина. На пластмасата той е слаб, абсолютно не на парафин, който пълзи с флуороводородна киселина в съдове, които се разграждат от материал.
Силата на ВЧ да легне в присъствието на вода. Сухата флуоридна вода не е подходяща за голямо количество метали и не реагира с метални оксиди. Въпреки това, веднага щом реакцията започне, отдавна е далеч от автокатализата, така че в резултат на промяната има много шофиране и подобрения:
MO + 2HF = MF2 + H2O
Ridky HF е силно йонизиращо средство. Цялата електролиза в нова, с винетка от хлорна киселина и HClO4, между другото:
HCl + 2HF ↔ ClH2 + + HF2-
В случай на водороден флуорид, киселинната мощност се показва наполовина като акцептори на йонния флуорид, например BF3, SbF5:
BF3 + 2HF → FH2 + + BF4-
Амфотерни спици в средата на най -богатия флуороводород е, например, алуминиев флуорид и хром (III):
3NaF + AlF3 → 3Na + + AlF6-
(AlF3 - якова киселина)
AlF3 + 3BF3 → Al3 + + 3BF4-
(AlF3 - като подстава)
Флуороводородът не се обменя във вода, когато молекулите на HF са йонизирани.
Цената е дадена на елементите от VIII група на групата на главата - вътрешни или благородни газове, поне някои от окончанията се наричат електронна топка. Електронната конфигурация на атомите и елементите е такава, че не може да бъде осъществена към метали, нито към неметали. Мирише с тези обекти, както в естествената система, те ясно разпределят елементите върху метал и неметал, които заемат мястото близо до тях. Инертните или благородни гази ("благородството" се върти по инерция) понякога се пренасят към неметали, макар и чисто формално, зад физическите знаци. Възможно е да се спести газоконвертираща мелница чак до дори ниски температури.
Енергията в химията е забележителна за тези елементи. За ксенона и криптона те са полуфлуорни и киселинни. Безумно, на бял свят, на заден план, газовете играеха ролята на предците.
Стойността на неметалните следи, която за тези атоми се характеризира с висока стойност на електрическата мощност. Оиа се променя в границите от 2 на 4. Неметали - предназначението на елементите на групите на главата, още повече елементи, вигнатокът става водата - s -елементът.
Всички неметални елементи (crim vodnyu) заемат в периодични системихимични елементи D. I. Менделева горен десен кът, трико, с флуор отгоре.
Особено важно обаче беше да се съсредоточим върху двусмислената обстановка в периодичната система: в I и VII групите на групите ръководители. Це не е випадково. От едната страна, атом на вода, подобен на атомите на чужди метали, има една електронна топка върху една (и една за нова) електронна топка (електронна конфигурация 1s1), която е по вина на състоянието на ума, показвайки мощност.
В голям брой от тях водата, подобно на локви от метал, показва степен на окисление +1, докато изходът на електрон от атом е по -важен, той е по -малко важен за атомите в други метали. От другата страна, водният атом, подобно на атомите на халогени, за завършването на последната електронна топка, брака на един електрон, този атом може да бъде взет от един електрон, показвайки силата на окисляване и характеристика на халогена на етапите на окисление, -1 в хидриди - метали с халогени - халогениди. Ако донесете един електрон до атома, той ще бъде по -важен, отколкото при халогените.
С ума на ума водата е H2 -газ. Молекула його, подобна на халогени, двуатомна.
Атомите на неметали разчитат на силни оксиди, така че силата на привличане на електричество. Качеството на характеристиката на стойността на електрическия негатив, която естествено се променя в периоди и в групи (фиг. 47).
флуор- най -силният окисляващ атом при химични реакции не е наличен за електричество, така че той показва голяма мощност.
Конфигуриране на нова електронна топка
Иншините неметали могат да покажат допълнителна мощност, ако я искат в значително по-висока степен по отношение на металите; В периодите и в групите е важно сградата да се променя във вихров ред в случай на окисляване.
Химически неметални елементи общо 161 Извикването на trocha, което е vrahuvati, се вижда в 114 елемента. Два неметални елемента съставляват 76% от масата на земните морбили. Джейсен (49%) и силиций (27%). Атмосферата съдържа 0,03% от масата в земната кора. Неметали се съхраняват 98,5% от масата на roslin, 97,6% от масата на човека. Редица неметали - C, H, O, N, P и S - са биогенни елементи, които могат да се използват за най -важната органична реч на живите клетки: напитки, мазнини, въглехидрати, нуклеинови киселини. Преди склада на повитрия, yakim mi dikhaєmo, има прости и сгъваеми думи, както и фиксиране на елементите с неметали (кислород кислород, азот, въглероден диоксид CO2, водни пари H2O и ин.).
воден ден - елемент на главатаВсесвита. Космическите обекти Bagato (газове, звезди, включително Sonce) се съхраняват повече от половината във вода. На Земята, включително атмосферата, хидросферата и литосферата, само 0,88%. Теглото е малко, а атомното тегло е още по -малко. Това не е чудесно място за изграждане, от кожата 100 атома на Земята 17 - атома вода.
Проста реч-неметална. Будова. Физическа сила
В прости думи, атомите на неметали са свързани с кова-лентон с неполярен пръстен. Персоналът се формира с по -голяма електронна система, по -ниска при изолираните атоми. В същото време, единични (например, в молекули на вода H2, халогени на Ki, Br2), подлинии (например, в молекули на сирки трон (например в молекули на азотни ковалентни връзки).
Както вече виждате, прости думи, неметали могат да бъдат майки:
1. Молекулярна Будова. С изключителни умове по -голямата част от тези речи са газови и, ако не и тежки, речи и само един бром (Br2) е по -малък от един. Всички речи на молекулярните будови, така летящи. В твърда мелница вонята се стопява поради слабостта на междумолекулното взаимодействие, което ще намали молекулите в кристалите и ще натрупа до сублимация.
2. атомно будова... Речите бяха одобрени от ланцерите на атомите. Чрез големите ковалентни връзки на вонята, като правило, изглежда, че е много твърда, и било то змии, обвързани с ковалентните връзки в техните кристали (топене, пари), голяма жизненост. Bagato taki rechovini mayut висока температуратопене и кипене, а летливостта е дори ниска. (При бебето 47 седалки са символи на тихи неметални елементи, тъй като отговарят само на атомни кристални решетки.)
Багато елементи -неметали създават пръскане на прости думи - алотропни модификации. Яко ви пом'ятаете, силата на атомите се нарича алотропия. Алотропията може да бъде свързана и от малко съхранение на молекули, и от нарастващ кристал от буд. Алотропна модификация във въглерод е графит, диамант, карабин, фулерен (фиг. 48).
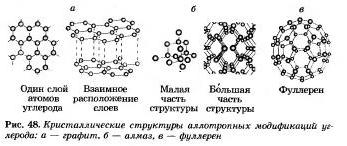
Елементи-неметали, които са силата на алотропията, се приписват на малката 47-та звезда. Така че, има повече прости неметални думи, отколкото повече, по-малко химични неметални елементи.
Знаете, че има три големи метала, зад един рядък винят (злато, среден и деяки), характерен за средно голямо вино. А оста на простата неметална реч, гамата от цветове има смисъл.
Безпрецедентно на голяма известност в физическа силанеметали, въпреки това е необходимо по някаква причина и deyakí ihkh zagalny ориз. Всички газоподобни речи, рядък бром, както и видове ковалентни кристали - диелектрици, както и всички най -нови електрони на викторианските атоми за установяване на химически звуци. Кристалите са непластични, ако това е деформация на нечестието, разрушаване на ковалентни връзки. Много неметали не показват метални отблясъци.
Веселите власти
Те означават също, за атомите на неметали, а също и за простите думи, които изясняват, те са едновременно окислителни и също така мощни.
Окисляване на силата на прости думи от неметали
1. Окислителната сила на неметалите се проявява на първо място в случай на тяхното взаимодействие с метали (както знаете, предците го хвърлиха):

Окисляването на силата на хлор Cl2 е по -силно, по -малко в сивото, а металът е Re, което е по -малко в долните етапи на окисляване +2 b +3. да се окисли до по -високо ниво на окисление.
2. Повечето неметали показват окислителна мощ при взаимодействие с вода. В резултат на това се задават летящи води.
3. Бъдете неметал в ролята на окислител в реакции с тези неметали, които могат да имат по-ниска стойност на електричеството:
Електроотрицателността на гроздето е по -висока, по -ниска от фосфора, така че има окисляване на мощността.
Електроотрицателността на флуора е по -висока, по -ниска във всички други химични елементи, което се дължи на факта, че окислителят е мощен.
Флуорът е най -силният окислител от неметали, показващ само окислителна сила в реакциите.
4. Окислителните сили на неметали се проявяват в реакции с действия сгъваеми думи... Не само кисен, бира и инши неметали, те могат да бъдат и окислители при реакции със сгъваеми езици - неорганични и органични.
Силно окисляващ хлор Сl2 окислява хлорида на zaliz (II) до хлорид на zaliz (III).
Вие се възползвате, zychay, като реакция на ненасилственото ziednanni - втвърдената бромна вода.
Видновата сила на прости изказвания - неметали
Когато се разглеждат реакциите на неметали, едно от същите означава, че в присъствието на отломките един от тях показва силата на окислителя, а последният показва силата на водача.
1. Според редукцията до флуор всички неметали (navit kisen) са с голяма сила.
2. Zrozumіlo, неметали, крим флуор, служат като редуциращи агенти при взаимодействие с kisne:

8 Bagato nemetelli може да виступатира в ролята на олово в реакции със сгъваеми рекички, окисляващи:
Има такава реакция, при която един и същ неметал веднага се окислява, по най-очевидния начин, реакцията на самоокисляване е самообновяване.
Отже, пидиб'амо пид торби! Повечето неметали могат да се появят в химични реакции както в ролята на окислител, така и в ролята на лидер (в допълнение към само флуора).
Водневи сполуки неметали
Благодарение на ревностната сила на всички неметали е установяването на летни водни растения, в голям брой неметали има по-ниски стадии на окисление.
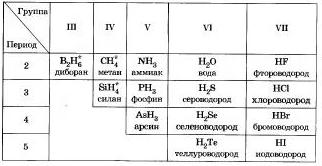
Всъщност през повечето време е възможно да се отхвърлят неметални метали без обмен, за да бъдат синтезирани.
Във водните обединения на неметали, вдоооанни коналени полярни свилямни, до молекулярни будова и в случай на големи умове са газове, крим вода (ридина). Lla vodnevyh z'udnan nonmetals се характеризира със сводеста совалка към води. META и enlan в никаква практическа оперативна съвместимост. Амониевият хидроксид, когато се разтваря във вода, се използва за предварително поставяне на плочите - амониев хидроксид.
Освен забележими авторитети, водата и половината неметали в оксидно-алкални реакции винаги показват авторитета на лидерите и дори в тях неметалът може да намали етапите на окисляване.
Неметални оксиди и общи хидроксиди
В неметалните оксиди връзките между атомите са ковалентни полярни. Средата на молекулярните оксиди е газоподобна, ридки (летливи), твърди (летливи).
Неметалните оксиди могат да бъдат разделени на две групи: несолеобразуващи и ледообразуващи. Когато киселинните оксиди се разграждат, хидратите на оксидите - хидроксидите - се установяват във вода, за тяхната природа - киселини. Киселините и киселинните оксиди в резултат на химични реакции образуват соли, в някои неметали се предприемат стъпките на окисление.
Оксидите и типовите хидроксиди са киселини, в някои неметали те показват окислителни стъпки, които са важни за броя на групите, така че те са важни, те се наричат храна. Когато разглеждат Периодичния закон, те също характеризират своя склад и мощ.
Укрепване на киселинната сила на оксидите и шдронепдопа В границите на една главна група, например, VI група, например, започва редовността на промените в силата на други оксиди и хидроксиди.
Ако неметалът е създаден от два или повече кисели оксида, а това означава, че и двата вида кисели киселини, тогава киселинността на неметала ще приеме по -високите нива на окисляване на неметала.
Оксидът и киселината, в които неметалът е основният етап на окисляване, могат да покажат само окислителна сила.
Оксидът и киселината, неметални, на междинните етапи на окисляване, могат да показват както окисляване, така и обща мощност.
практическа работа
1. Преди каквито и да е електронни роднини ukis елементи-неметали?
2. Какви са неметалните елементи е биогенен?
3. Какви фактори са валентните способности на неметалните атоми? Разгледайте приложението на атомите и сестрите.
4. Защо някои неметали с необикновен ум - гази, инши - са твърди огнеупорни думи? 5. Да направлява задните части на прости неметални думи, така че да могат да бъдат чути с големи умове в малка съвкупна мелница: а) газоподобна, б) груба, в) твърда.
6. Склад за участие на неметали. Каква мощност (или окисляване или въвеждане) показват неметали в тези реакции?
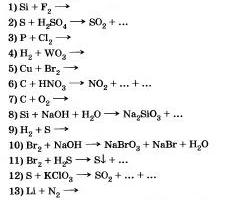
Какви са причините, поради които температурата на водата и солната киселина все още е много по -висока от температурата на водата и сероводорода?
7. Защо сутрин метанът е бърз, а при следващото самозаемане е силен: флуороводородът е бърз преди нагряване, йод-вода дори при слабо нагряване се отлага върху йод и вода?
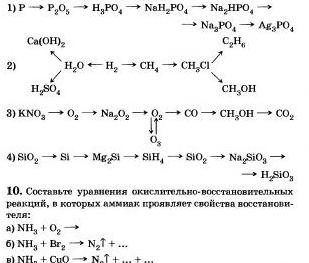
8. Запишете правилните реакции, за чиято помощ можете да отидете на:
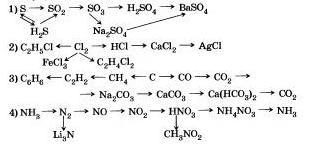
9. Запишете подобни реакции, за чиято помощ можете да отидете на:
12. През пролуката, за да отмъстят за 10 g течен натрий, те преминаха 20 g вода. Yaka sil и в какъв вид wyde?
Вид: 0,25 mol NaHS.
14. По време на обработката на 30 g вапняк със солна киселина, 11 g бяха взети във въглероден диоксид. Yaka Masova Chastka към калциев карбонат в естествен Vapnyak? Отговор: 83,3%. 15. Застосована в медицинска йодна тинктура е 51% разтвор на кристален йод в етилов алкохол. Яки obsyag алкохол, яко капацитет 0,8 g / ml. трябва ли да приготвите 250 г от такъв размер?
Тип: 297 мл. 16. Сумата от силиций, графит и калциев карбонат с тегло 34 g се взривява с натриев хидроксид и се обработва с 22,4 литра газ (n.U.). По време на обработката на такава част от сумата със солна киселина, 2,24 литра газ (n.U.) бяха отстранени. Вижте масовия склад на сумата.
Образец: 14 g 81: 10 g C; 10 g CaCO2.
17. Газообразен амиак с обем 2,24 l (n.u.) 20 g от количеството фосфорна киселина в масова част от 49%. Yaka sil беше направено, yaka her masa?
Тип: 11,5 g
19. Какъв обем амиаку е необходим за отстраняването на 6,3 тона азотна киселина, което е необходимо за консумацията на 5%?
Тип: 2352 м3.
20. С природен газ с обем 300 литра (н.у.) ацетиленът се отстранява с голяма част от метана в газ, 96%. Visnagte yogo obsyag, yakho vyhіd продукт 65%.
Изглед: 93,6 л.
21. Първо, започнете структурната формула за въглехидрати със съотношение 1.862 и масова част във въглерод от 88.9%. Изглежда, във въглехидратите във връзка с амонячния разтвор, оксидът на средата.
Ролята на неметалите в живота на хората
Неметалите в живота на хората играят голяма роля, тъй като без тях животът не е омразен не само за хората, но и за тези живи организми. Aje zavdyaki така неметални елементи, Як кисен, във въглища, вода и азот се установяват аминокиселини, за което време има бутилки, без които е невъзможно всеки да живее на Земята.
Нека с уважение погледнем снимката по-долу, на която са представени основните неметали:

И сега, нека разберем неметалните действия по-подробно и значението на тяхното значение, тъй като те миришат в живота на хората и в техния организъм.
Животът на хората не може да се разбере ни най-малко, както е в къщата, а през всяко друго време има много неметали и знанието за тях. За тези, които не са осигурили функциите на нашето тяло, те са заети с кисен и към тях се добавят азотни и други газоподобни думи, а те самите грабват замаяните ни благородници. Също така в хода на биологията ще видите, че всички функции на тялото са ясно свързани с очевидната киселинност.
В резултат на проникването на зъбната UV viprominuvannya, при разрушаването на нашето тяло, озонът се задържа.
Такъв необходим микроелемент, като сирка, в тялото на хората, е в ролята на красотата, както и на работниците, шкира, черни и коса, за да станат здрави. Също така, не е въпрос на забравяне, но сирка се грижи за съдбата на хрущялната и кистозната тъкан, като помага за излъскването на робота на захарните плочи, като прави тъканите ни по -важни за здравето на хората.
Аниони към хлора също играят важна биологична роля за хората, тъй като участват в активирането на ензимите. С помощта на помощта получавам приятелска среда в пропастта и получавам осмотична хватка. Хлорът, като правило, се консумира в тялото на хората, готвачи от кухненска сол, когато го получат.
Много важни качества, тъй като неметалите се поставят върху човешкия организъм и върху живите организми, в процеса на застой и в другите малки галуси.
съхраняване на неметали
воден ден
Такова разнообразие от неметали, като вода, се използва широко в химическата промишленост. Използва се за синтез на амоняк, метанол, хлорна вода, както и за хидрогениране на мазнини. По същия начин не можете да правите без участието на вода, като подновяване в случай на виробнстви багатох метал и техния zеdnan.
Водата се използва широко в медицината. По време на лечението на рани и за zupinki на друго кървене, има триоксид пероксид пероксид.
хлор
За производството на солна киселина, каучук, винилхлорид, пластмаси, както и органични отпадъчни продукти, използвайте хлор. Yogo vikoristovuyut в такива обещания, като текстил и документи, като смесено палто. На основата на тръбата, хлорът е незаменим за заразяването на питейна вода, така че, с оксиди на Володи, той има по-дезинфекционен ефект. С такава мощност, вода и хлор, и вода.
За медицински цели, като правило, натриевият хлорид е под формата на fizrozchin. На тази основа те вибрират много водни течности.
сирка
Такъв неметален, сирка, використовойт за производство на сирчанова киселина, барут, сирников. Възможно е и замръзване по време на вулканизация на каучук. Останете си вкъщи с барвници и луминофори. А колоидната сирка е необходима в медицината.
Сирка знаеше застоя в достойнството на копринената държава. Її vikoristovuyut, фунгицид на Як, за борба с деца.
При синтеза на полимерни материали, както и за получаването на други лекарствени препарати, такива неметали, като йод и бром, са широко използвани.







